从阿卡替尼在国内申报新适应症,浅谈国内BTK抑制剂研发现状
2022-12-27
并购加速审批申请上市
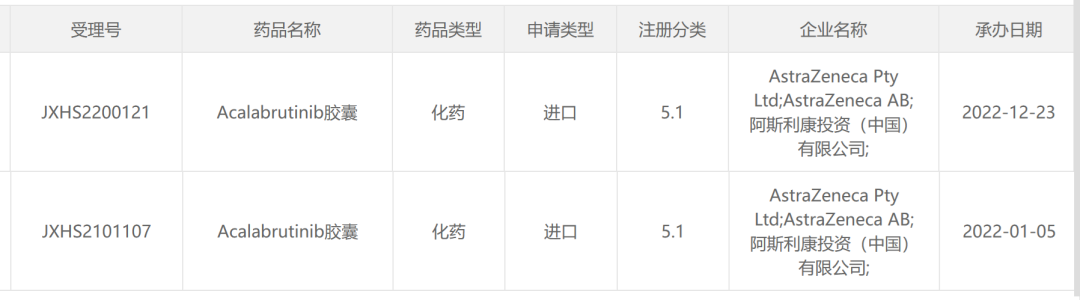
12月23日,阿斯利康BTKBTK抑制剂「Acalabrutinib胶囊」在国内递交的第二个上市申请获CDE受理。
Preview
来源: 药渡Daily
来源:CDE官网
Acalabrutinib(阿卡替尼,商品名Calquence)是第二代布鲁顿氏酪氨酸激酶(BTK)抑制剂。与传统BTK抑制剂相比,Acalabrutinib提高了BTK的靶点选择性,更精准靶向BTK,避免或减少“脱靶”作用,具有良好的耐受性和更好的治疗潜力,降低临床上不良反应的发生率。
2017年10月,Acalabrutinib被FDA加速批准用于治疗既往已接受至少一种疗法的复发性或难治性成人套细胞淋巴瘤(MCL)。2019年11月,该药又被FDA批准用于治疗成人慢性淋巴细胞白血病(CLL)或小细胞淋巴瘤(SLL)。
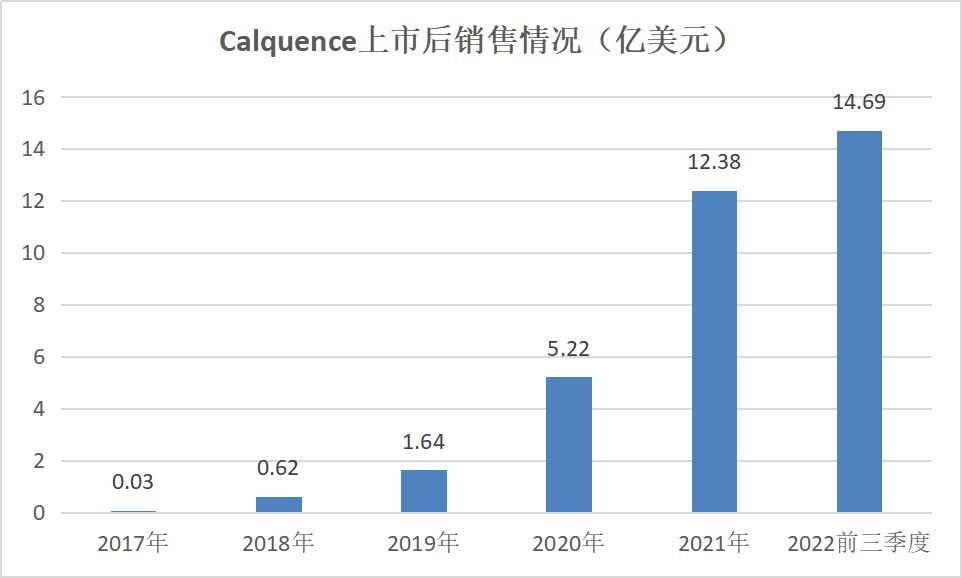
Acalabrutinib最初由Acerta Pharma研发,2016年阿斯利康通过收购Acerta Pharma获得该药。Acalabrutinib也不负众望,上市后销售额一路攀升,2021年进入10亿美元行列。
Preview
来源: 药渡Daily
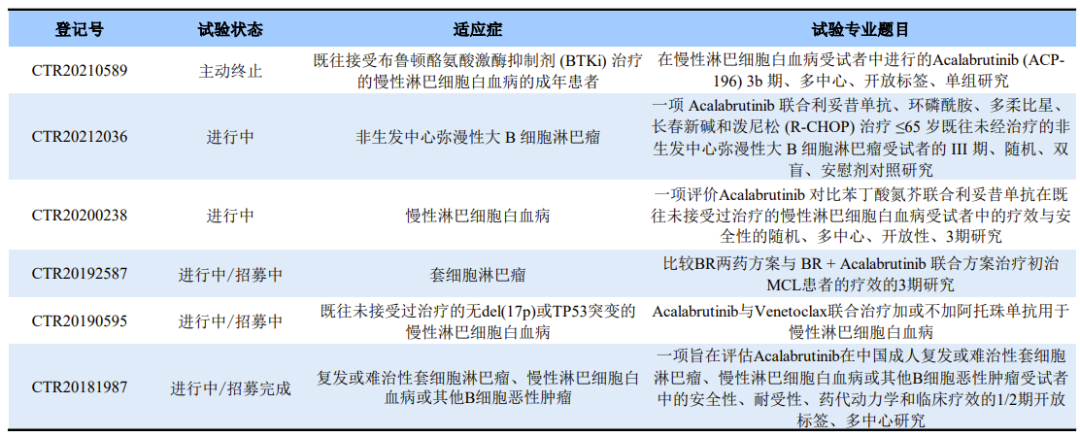
在国内,Acalabrutinib共登记4项临床试验,适应症涉及MCL、CLL和非生发中心弥漫性大 B 细胞淋巴瘤。据阿斯利康2022Q3财报,笔者推测此次申报的适应症为CLL。若顺利,Acalabrutinib有望成为国内批准的第四款BTK抑制剂。
Acalabrutinib在国内的临床试验登记情况
Preview
来源: 药渡Daily
资料来源:CDE官网
国内BTK抑制剂市场三足鼎立 (2款国产+1款进口)
BTK(布鲁顿型酪氨酸激酶)是B细胞受体(BCR)信号通路的关键调节因子,主要负责B细胞内外信号的传导与放大,当机体发生免疫应答时,B细胞信号通过活化BTK而激活,进而调控B细胞的生长、发育、分化和增殖。BTK的异常与癌症或自身免疫病关系十分密切,BTK抑制剂被开发用于治疗血液肿瘤以及自身免疫性疾病,如多发性硬化。
伊布替尼
伊布替尼(Ibrutinib,商品名:亿珂)是全球批准的首款BTK抑制剂,由强生/艾伯维(Pharmacyclics)共同开发,目前已在国内获批多各适应症:(1)单药治疗既往至少接受过一种治疗的CLL/SLL、MCL(2017/08)。(2)一线治疗CLL/SLL(2018/07)。(3)单药治疗既往至少接受过一种治疗的华氏巨球蛋白血症(WM)(2018/11)。(4)今年5月,该药又在国内申报新适应症,相关受理号为:JXHS2200052。
泽布替尼
奥布替尼
泽布替尼*国药之光*
头对头研究完胜BTK抑制剂领头羊伊布替尼
泽布替尼是我国史上首个在美获批的本土研发抗癌新药,最早于2019年11月被FDA批准用于治疗经治一次的MCL,而且其二线治疗复发性或难治性边缘区淋巴瘤(R/R MZL)的新药申请也于2021年9月在美国获得首次批准。近期,泽布替尼再次赚足眼球,其对比伊布替尼治疗难治复发性CLL的III期试验ALPINE的最终分析结果成功发表于《新英格兰医学杂志》(NEJM),成为中国本土药企研发创新药首个发表于NEJM的大型国际多中心临床试验结果。
ALPINE研究是一项非盲开放、随机对照、国际多中心III期临床试验,2018年开始招募患者,共入组来自中国、美国、欧洲、英国、澳大利亚、新西兰等15个国家的652例复发或难治性CLL或小淋巴细胞淋巴瘤(SLL)患者。研究中患者按照1:1比例随机分配接受泽布替尼或伊布替尼治疗,至疾病进展或出现不可接受的毒性。研究主要终点为经研究者评估的客观缓解率(ORR),关键次要终点包括无进展生存期(PFS)、持续缓解时间、总生存期(OS)以及不良事件(AE)发生率。
在研BTK抑制剂注重差异化布局
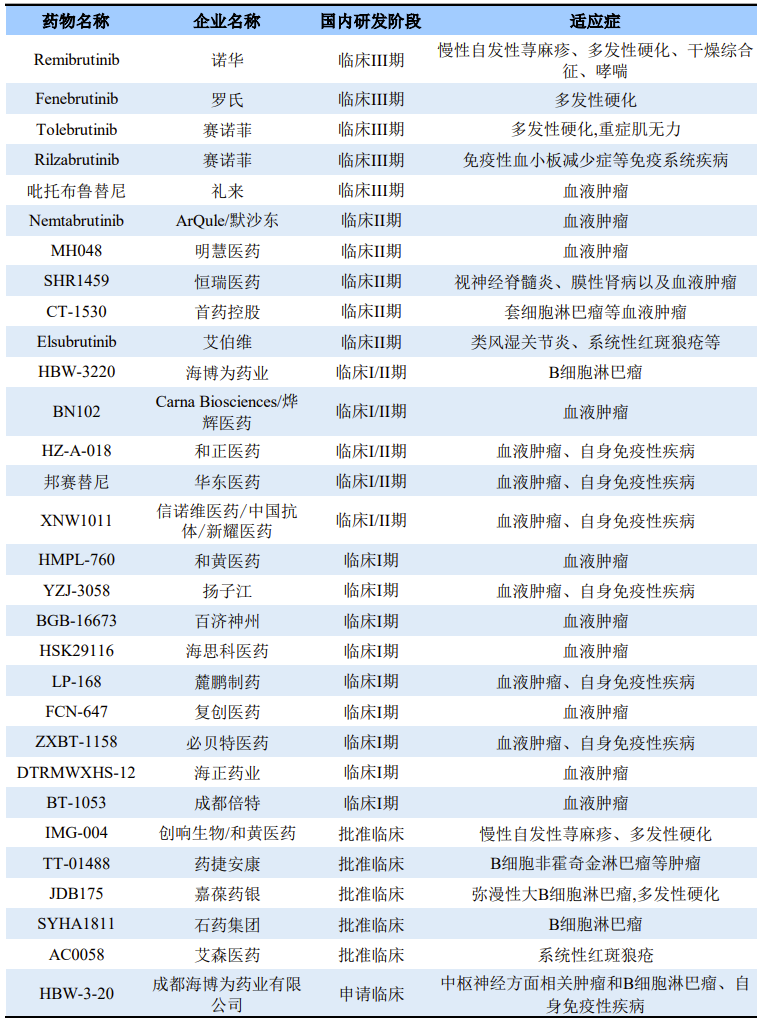
30+进入临床/获批临床此外,目前国内超30款在研BTK抑制剂进入临床或申报临床。5款进入III期临床的BTK抑制剂均为进口,适应症主要围绕自身免疫学疾病,其中礼来的吡托布鲁替尼(Pirtobrutinib)针对BTK抑制剂常见的C481S突变,2019年礼来以80亿美元收购 Loxo Oncology 揽获这款药物。2021年12月,礼来向FDA滚动递交Pirtobrutinib(LOXO-305)治疗套细胞淋巴瘤的新药上市申请。
除了Pirtobrutinib,国内还有几款BTK C481S抑制剂,如默沙东Nemtabrutinib、海博为药业的HBW-3220、烨辉医药的BN102、和黄医药的HMPL-760。
国内在研BTK抑制剂
Preview
来源: 药渡Daily
总结
内容来源于网络,如有侵权,请联系删除。
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。





