新冠疫情之外,mRNA的三大“用武之地”:抗肿瘤疫苗、蛋白替代疗法、细胞疗法
2022-06-02
信使RNA疫苗抗体免疫疗法细胞疗法
在新冠疫苗的竞赛中,mRNA作为一种安全、有效的技术平台,加速了全球对于mRNA-LNP系统风险/获益的认知。
Nature Biotechnology杂志发表了题为“The clinical progress of mRNA vaccines and immunotherapies”的综述文章,回顾了mRNA疫苗及相关免疫疗法的临床进展。在《Nature深度好文:mRNA疫苗5大优势、7大改进方向……》一文中,我们重点介绍了“预防性mRNA疫苗”相关的内容,本篇将聚焦抗肿瘤mRNA疫苗及基于mRNA的蛋白免疫疗法与细胞免疫疗法。
抗肿瘤mRNA疫苗
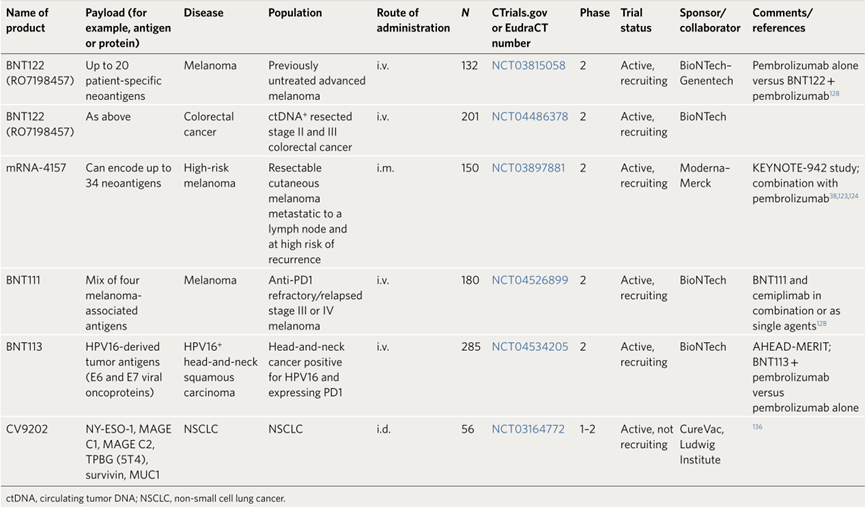
Preview
来源: 生物谷
部分在研临床II期与III期抗癌mRNA疫苗(来源:Nature Biotechnology)
1.肿瘤相关抗原
BNT111由编码4种黑色素瘤相关抗原[纽约食管鳞状细胞癌1(NY-ESO-1)NY-ESO-1)、酪氨酸酶、黑色素瘤抗原A3(MAGE A3)和跨膜同源性磷酸酶-张力蛋白(TPTE)]的mRNA构成。4种TAA的mRNA序列均经过优化,可在未成熟的DC细胞中翻译出对应蛋白。每个序列还包含一段信号肽、破伤风类毒素CD4+P2和P6表位以及用于增强人类白细胞抗原( HLA )的抗原提呈和免疫原性功能的主要组织相容性复合体( MHC )Ⅰ转运结构域。
每次给药后,患者体内IFN-α、IFN-γ、IL-6和其他细胞因子水平提高,通常在接种后数小时达到峰值,24小时后恢复至正常水平,而这与观察到的不良反应事件发生特征一致。不良反应主要是轻度至中度的流感样症状,通常持续时间短暂且具有自限性(自限性疾病是指在疾病发生发展到一定程度后可以自动停止,并逐渐恢复痊愈的疾病,如水痘、玫瑰糠疹、斑秃和普通感冒等)。42例患者的影像学首次评估结果令人振奋。在25例接受单一疗法的受试者中,3例部分缓解,7例疾病稳定;而17例接受疫苗与PD-1联合疗法的患者中,6例部分缓解。有趣的是,2例曾接受抗PD-1治疗后疾病进展的患者,在接种疫苗后重新对PD-1疗法有响应,这一结果支持诱导T细胞属于PD1+效应记忆性T细胞表型的结论。目前,BNT111正在进行黑色素瘤的临床II期试验。
2.个性化新抗原
BNT122(RO7198457)可编码多达20种个性化新抗原。初步结果表明,该药物单一疗法或与PD-1药物阿替利珠单抗(atezolizumab)PD-1药物阿替利珠单抗(atezolizumab)联合使用都具有可接受的安全性,而不良反应主要是输液相关的反应和(或)细胞因子释放综合征(发热、寒颤等)。目前,BNT122正在进行黑色素瘤、非小细胞肺癌、结直肠癌的II期临床和三阴性乳腺癌的I期临床试验。
蛋白免疫疗法与细胞免疫疗法
mRNA的一个新兴领域是体内编码可用于治疗的免疫蛋白或免疫调节蛋白,如抗体与细胞因子。与传染病疫苗、肿瘤疫苗相比,这些疗法需要产生更多的蛋白才可发挥作用,某些疾病甚至需要终身服药。
蛋白免疫疗法的一大挑战是将mRNA递送到所有目标器官和细胞中,实现最佳的治疗效果。例如,某些蛋白需要进一步PTM(如糖基化与蛋白水解)才能充分发挥功能。而PTM对蛋白的修饰作用可能是组织依赖性的,而不仅仅取决于mRNA的序列,这进一步说明mRNA需要特异性递送至目标组织。
当mRNA以LNP为载体全身给药时,由于载脂蛋白E可结合至LNP表面,LNP复合物将倾向于分布到肝脏组织,肝细胞表面受体将诱导LNP颗粒的肝细胞摄取。通过调整LNP中脂质成分(包括调整脂质比例和组成)可实现非肝脏的特异性组织分布,如肺组织内皮细胞或脾脏的靶向递送。最近,通过调节PEG-脂质结构,改变LNP表面性质,实现了LNP特异性靶向造血干细胞生态龛中的骨髓内皮细胞。
因此,与疫苗相比,mRNA蛋白免疫疗法在制剂递送、蛋白生产有效性和耐受性方面提出了新的挑战。这也可能是mRNA治疗药物比mRNA疫苗开发进度慢的原因。
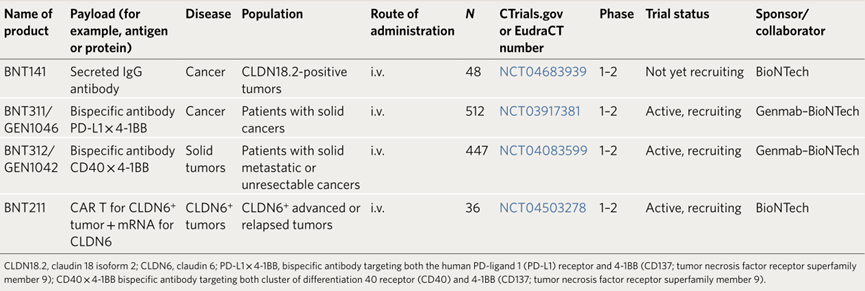
Preview
来源: 生物谷
部分在研临床II期与III期基于mRNA的蛋白替代疗法(来源:Nature Biotechnology)
1.mRNA编码单抗疗法
直接将mRNA递送至特定组织或器官是mRNA药物开发的屏障。只要药物是安全的,同时合理设计给药剂量控制蛋白表达水平,mRNA药物全身给药是一种合适的给药途径。mRNA-1944是一种编码单克隆抗体(mAb)的mRNA药物。这种药物以LNP为载体,编码一种识别基孔肯雅病毒(Chikungunya virus)的mAb。首项基于健康受试者的临床试验数据表明,所有试验剂量(0.1,0.3,0.6 mg/kg)中都可以检测到中和抗体。但在最高剂量组下,4例受试者中3例出现输注相关反应,其中1例受试者出现3级心动过速、白细胞计数升高、2级恶心、呕吐、发热,同时心电图上存在短暂倒置T波。而经类固醇预处理的同一剂量组别下的另一组受试者没有出现3级不良反应,但基孔肯雅病毒特异性抗体水平(Emax)降低了1.7倍。
以mRNA产生抗体吸引了很多关注,目前业内有多项该领域的合作正在进行。例如,CureVac正和Cenmab合作开展一项基于mRNA的mAb抗肿瘤疗法;Neurimmune和Ethirs合作开展了吸入式mRNA药物,编码抗新冠mAb。这里需要重点考虑的因素是,为什么采用mRNA体内编码抗体,而不是利用传统的重组生产工艺?最有潜力的方法需要综合考虑给药剂量、持续时间、PTM类型、递送系统和目标抗体的安全性等因素。
2.mRNA编码免疫刺激蛋白
3.过继免疫细胞疗法中的mRNA
纳米制剂帮助mRNA递送至不同的免疫细胞,如巨噬细胞、B细胞和T细胞等,进一步扩大了免疫疗法的应用前景。例如, T细胞靶向递送mRNA技术为体内生成CAR-T细胞创造了可能性,开辟了肿瘤治疗的新方式。
mRNA疗法的优势与改进空间
1、优势
mRNA在基因疗法和蛋白疗法中占据了独特的地位,结合了两种疗法的优势,又规避了二者面临的挑战。例如,在生物反应器中生产多聚体蛋白难度很大,而这一挑战可以通过单个mRNA或多种mRNA编码蛋白不同亚基后,在患者体内自组装解决。
通过对重组蛋白的研究,mRNA疗法的潜力将进一步扩大。例如,mRNA可编码Fc结构域与治疗结构域的融合蛋白,可有效延长蛋白质的体内半衰期。而更令人兴奋的是将mRNA用于细胞疗法。mRNA基因编辑的瞬时作用可以避免永久表达带来的不良反应。此外,细胞内表达抗体、抗体片段或其他蛋白结合基序可在特定的细胞器(如细胞核)表达,以充分发挥编码蛋白的功效。
2、改进空间
由于RNA可以通过TLR和RIG-1信号通路激活免疫系统,RNA的免疫刺激性对mRNA药物具有非常重要的意义。例如,CV8102没有编码能力,而是作用免疫佐剂。这种免疫刺激性的缺点在于可能引发某些mRNA药物的安全性与耐受性问题。越来越多的证据表明,mRNA药物最常见的副作用是某些炎症反应。例如,在肌内注射或皮下注射时会出现疼痛、红肿、酸胀的局部反应;在肌内注射或吸入药物时可能出现发热综合征或流感样反应。这些症状都可以用抗炎药处理。在静脉注射编码基孔肯雅病毒mAb的mRNA的临床试验中,接受最高剂量的受试者中预先采用类固醇处理可以降低不良反应的发生率,但是这种处理方法降低了编码蛋白的表达水平。
回答这些问题并不简单,因为大多数mRNA药物并不是直接注射裸mRNA,而是将其包裹在LNP或PNP中,提高制剂的耐受性。后续的临床试验中,对照组中采用不含mRNA的空白LNP有助于回答mRNA和LNP对制剂耐受性的作用。但是这种对照也有一个缺陷,即空LNP不与带负电荷的mRNA结合时,其物理化学性质与装载有mRNA的LNP制剂不同,不能称为一个严格的对照组。
除即刻耐受性外,脂质蓄积带来的长期问题也需要考虑。若mRNA编码的蛋白质半衰期较短,则需要缩短给药间隔以维持临床疗效所必须的蛋白表达量,这可能引发脂质在靶组织和非靶组织中的蓄积,带来健康风险。mRNA的处方工艺将与mRNA生物学一道成为未来研发的重点。
mRNA的给药途径也很有想象空间,如肌内给药、皮内给药、皮下给药、淋巴结注射、瘤内注射、静脉注射和吸入给药等。经过进一步发展,未来有望实现鼻内疫苗、滴眼液或滴鼻液、皮肤药膏、肛门栓剂、膀胱灌注溶液、鞘内输注或Ommaya囊等。未来mRNA的治疗领域将直接取决于纳米药物递送技术的进步。越来越多的证据表明,LNP和PNP可以实现机体组织靶向(如肝脏、内皮、肺、骨骼以及免疫系统的多个组织)。而通过对递送材料的改进以及其他功能性材料的修饰,提高递送系统的靶向性与递送能力,mRNA的应用场景将进一步拓宽。
目前,两款经EUA获批的新冠疫苗凸显了mRNA的一大优势,即临床试验药物的快速生产能力。最初为个体化新抗原疫苗开发的制备工艺使得新冠病毒序列公布后的数周,候选mRNA疫苗临床试验随即展开,充分证明了其快速响应能力。
然而,新冠疫苗的使用也凸显了这项技术的另一个问题:对冷链贮存与运输的依赖。mRNA需要在-80℃贮存与运输,不是所有药房和临床试验基地都具备这样的条件;对于患者在家中自行给药,-20℃的保存条件都可能难以满足。因此,提高mRNA药物的稳定性将是其处方工艺研究的下一个重点。
小结
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
适应症
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。




