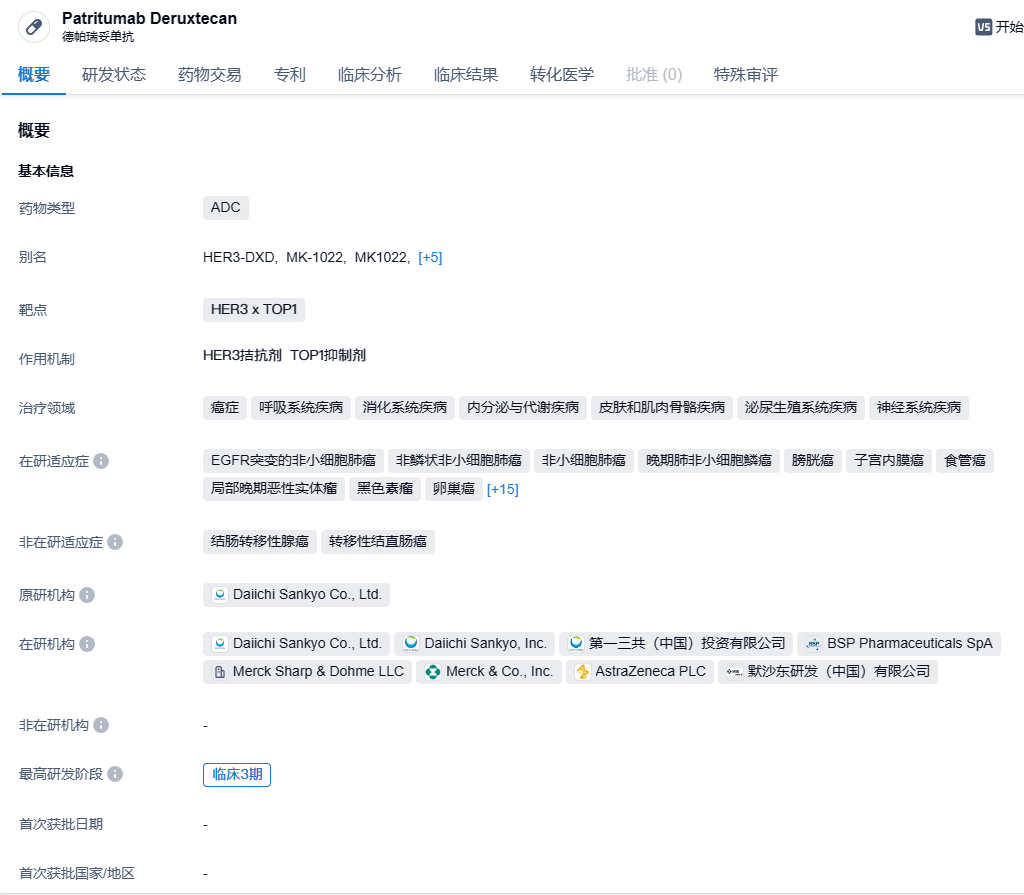
第一三共/默沙东HER3 ADC patritumab deruxtecan临床试验达终点,针对NSCLC
9月18日,第一三共与默沙东共同公布ADC合作产品patritumab deruxtecan(HER3-DXd)在HERTHENA-Lung02临床3期试验中的积极结果。这项研究评估了HER3-DXd用以治疗既往曾接受过EGFR-TKI治疗的EGFR突变局部晚期或转移性NSCLC患者。
Patritumab deruxtecan是一款采用第一三共技术设计的潜在first-in-class靶向HER3的DXd ADC,目前正由第一三共公司和Merck联合开发。2023年10月,第一三共和默沙东就第一三共的三款ADC候选药物:patritumab deruxtecan(HER3-DXd)、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)达成了全球开发和商业化协议,将在全球范围内共同开发和潜在商业化这些候选ADC疗法。第一三共将保留日本的独家权利。第一三共将全权负责产品生产和供应。
分析显示,该试验达到主要终点,与铂类加培美曲塞诱导化疗及后续培美曲塞维持疗法相比,patritumab deruxtecan在统计学上显著改善患者的PFS。分析时OS数据尚不成熟,试验将持续进行以评估次要终点OS。试验中所观察到的安全性与之前临床试验中的安全性一致,没有发现新的安全信号。两家公司表示,将与全球监管单位就该试验结果进行进一步的讨论。
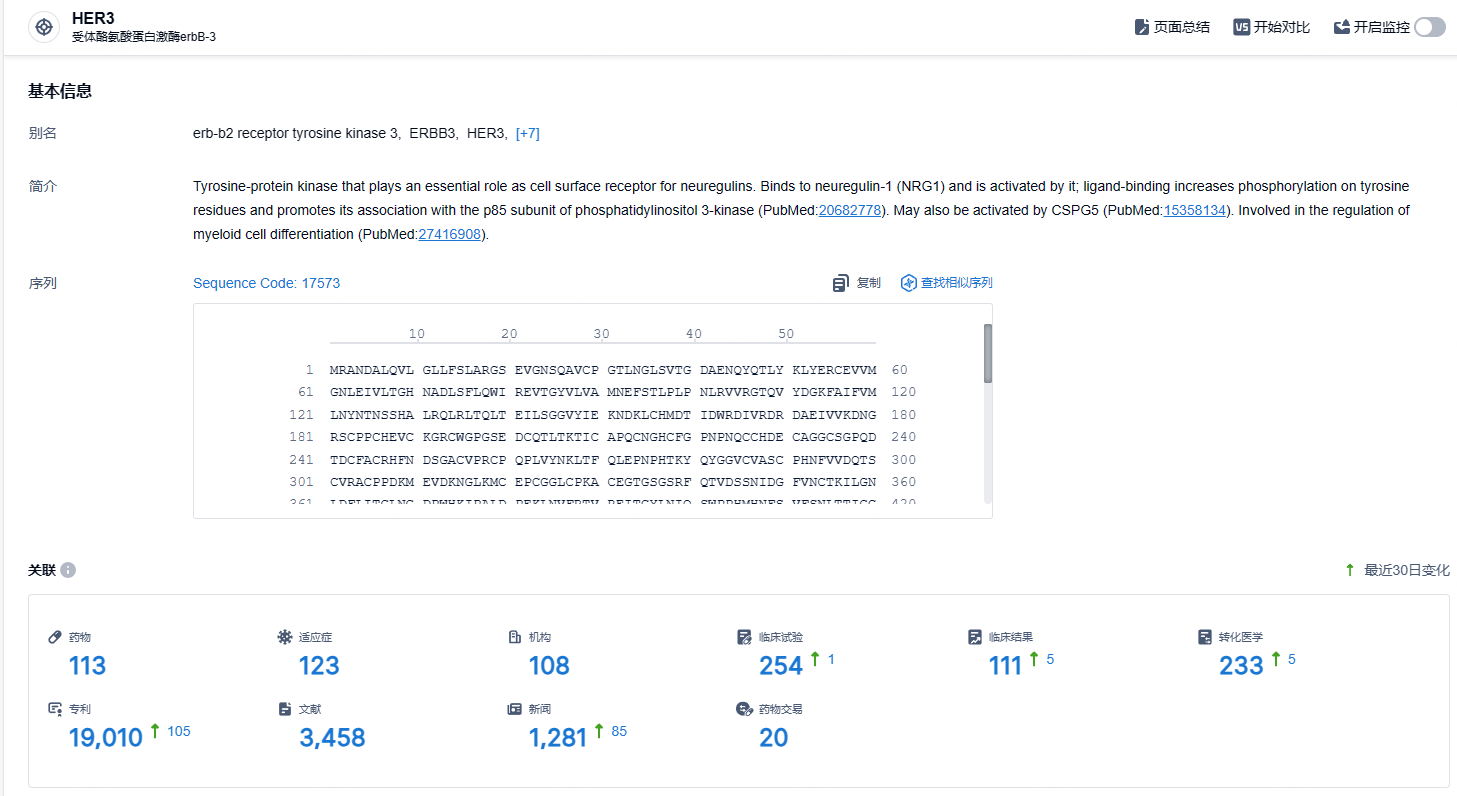
根据智慧芽新药情报库所披露的信息 (点击下方图片直达HER3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年9月19日,HER3靶点共有在研药物113个,包含的适应症有123种,在研机构108家,涉及相关的临床试验254件,专利多达19010件……目前,HER3赛道尚无新药上市。2024年7月,第一三共/默沙东的靶向HER3的抗体偶联药物(ADC)HER3-DXd(patritumab deruxtecan)的上市申请被FDA延期批准,其适应症为用于治疗既往至少接受过两种系统治疗的EGFR突变型局部晚期或转移性非小细胞肺癌(NSCLC)患者。据悉,被延期的原因主要是由于第三方制造设施检查相关的调查结果,其疗效和安全性数据并未存在问题。期待该药早日成功上市。