诺华CDK4/6抑制剂瑞波西利新适应症获FDA批准,乳腺癌辅助治疗
9月18日,诺华宣布美国FDA已批准CDK4/6抑制剂Kisqali(ribociclib,瑞波西利)联合芳香酶抑制剂(AI),作为高复发风险的激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)II期和III期早期乳腺癌(EBC)患者的辅助治疗,包括无淋巴结转移(N0)的患者。
瑞波西利(ribociclib,Kisqali)是FDA批准的第二款CDK4 x CDK6抑制剂,2017年3月被FDA批准联合一种芳香酶抑制剂,作为一种初始内分泌疗法,用于HR+/HER2-局部晚期或转移性乳腺癌绝经后女性患者的一线治疗。随后,该药又被FDA批准用于治疗HR +/HER2-晚期或转移性女性乳腺癌患者,成为首款联合芳香酶抑制剂治疗绝经前、围绝经、绝经后女性患者的CDK4/6抑制剂。2023年1月,瑞波西利首次在华获批上市,适应症为联合芳香化酶抑制剂(AI)一线治疗绝经前或围绝经期HR+/HER2-晚期乳腺癌;随后5月,瑞波西利获批适应症扩大至绝经后HR+/HER2-局部晚期或转移性乳腺癌,与AI联合用药作为女性患者的初始内分泌治疗,使得瑞波西利成为国内首个且目前唯一一款在晚期乳腺癌一线治疗领域覆盖绝经前/围绝经期、绝经后人群的CDK4/6抑制剂。

该批准基于关键性3期临床试验NATALEE的积极结果,在接受Kisqali联合内分泌治疗(ET)辅助治疗的HR+/HER2-早期乳腺癌患者中,与单独接受ET的患者相比,复发风险显著且具有临床意义地降低了25.1%(HR=0.749;95% CI:0.628,0.892;P=0.0006),包括具有高风险的N0患者。在所有患者亚组中均一致观察到侵袭性无病生存期(iDFS)的改善。
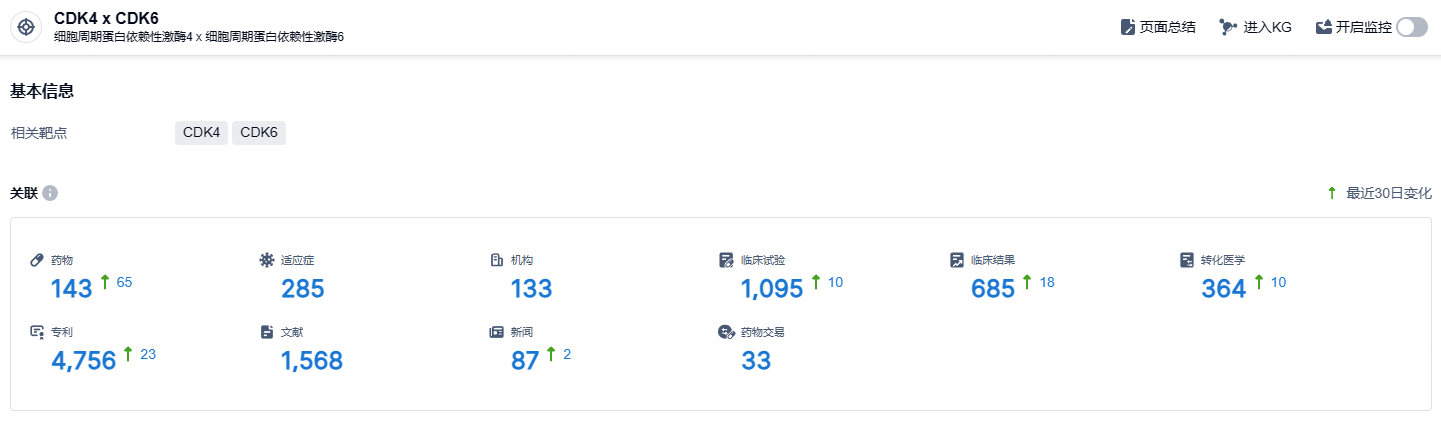
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CDK4 x CDK6靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年9月19日,CDK4 x CDK6靶点共有在研药物143个,包含的适应症有285种,在研机构133家,涉及相关的临床试验1095件,专利多达4756件……目前,CDK4/6抑制剂Kisqali(瑞波西利)已在全球近百个个国家/地区获批上市,今年上半年销售额13.44亿美元,同比增长68%,转移性乳腺癌新增处方占比47%,居于领导地位。此前诺华曾预测Kisqali 在晚期乳腺癌适应症方面,销售高峰可达到40亿美元,值得大家期待。