罗氏PD-L1单抗阿替利珠单抗皮下注射剂在美获批上市,可7分钟完成给药
9月13日,罗氏旗下基因泰克宣布,阿替利珠单抗皮下注射剂已获FDA批准上市,这是美国地区首个也是唯一一个用于皮下注射的PD-(L)1抑制剂。
阿替利珠单抗是罗氏开发的一种靶向PD-L1的单克隆抗体,可阻断肿瘤细胞表达的PD-L1与免疫细胞上的PD-1和B7.1受体相互作用并激活T细胞。目前,阿替利珠单抗已在全球范围内获批用于治疗非小细胞肺癌(NSCLC)、小细胞肺癌(SCLC)、肝细胞癌、尿路上皮癌、PD-L1阳性转移性三阴性乳腺癌和BRAF V600突变的晚期黑色素瘤等多种癌症。阿替利珠单抗静脉输注剂型(商品名:Tecentriq)于2016年5月在美国获批上市。2023年8月,基于IMscin001研究的积极数据,阿替利珠单抗皮下注射剂型(商品名:Tecentriq SC)首次在欧盟获批上市;2023年9月,Tecentriq SC(atezolizumab,阿替利珠单抗)皮下制剂获得英国药品和医疗产品监管署(MHRA)批准上市。与耗时30-60分钟的静脉输注相较,Tecentriq皮下注射大约仅需7分钟。
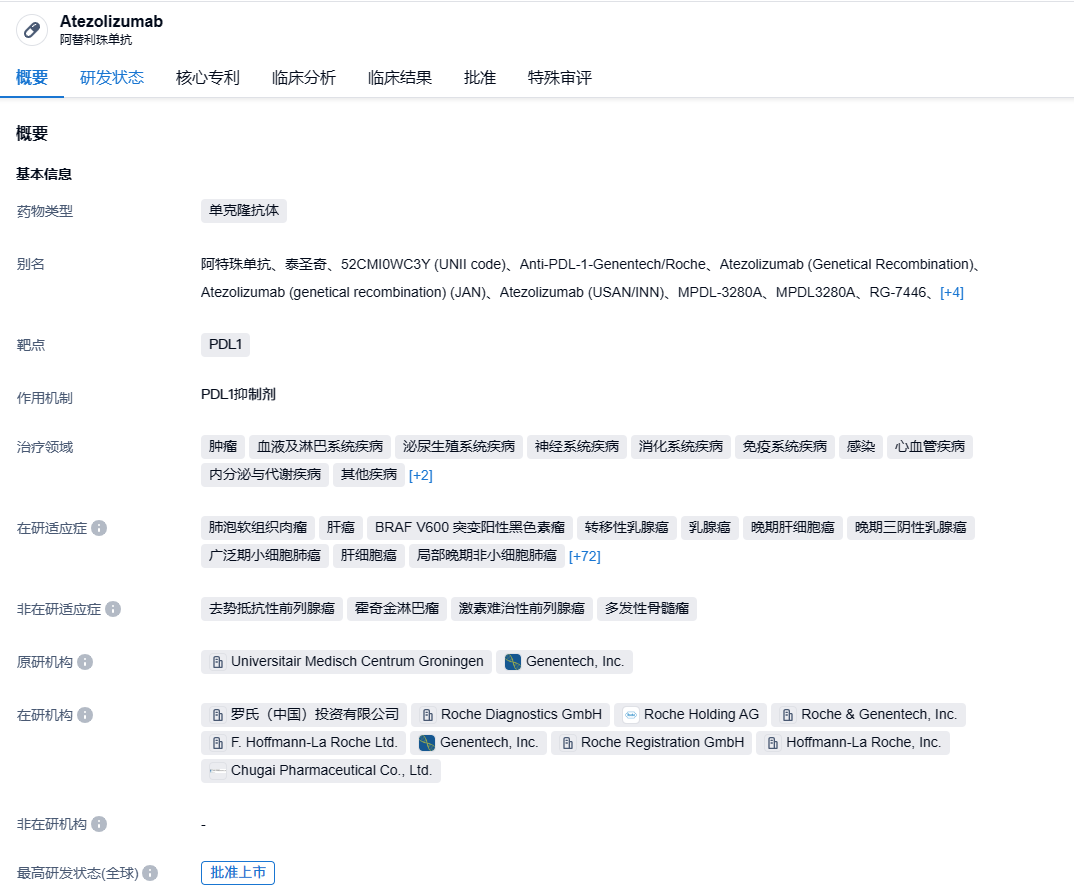
阿替利珠单抗皮下制剂将阿替利珠单抗与Halozyme Therapeutics的Enhanze药物输送技术相结合。Enhanze药物输送技术基于一种专有的重组人透明质酸酶PH20(rHuPH20),该酶可暂时降解人体内的透明质酸,从而使Tecentriq皮下制剂能够迅速分散并吸收到血液中。2022年12月1日,罗氏公布PD-L1抗体阿替利珠单抗(Tecentriq)皮下制剂的III期IMscin001研究的新数据:在既往接受过治疗的局部晚期或转移性非小细胞肺癌(NSCLC)患者中,皮下注射阿替利珠单抗较标准的静脉输注相比具有相当的暴露量(血液中的分子水平)以及相似的有效性与安全性。罗氏已向全球监管机构提交了IMscin001研究的数据,并为阿替利珠单抗皮下制剂寻求批准静脉输注剂型的所有获批适应症。阿替利珠单抗皮下制剂与静脉输注组的疗效相似,并且与静脉输注剂型的已知情况一致。具体来看,皮下注射和静脉输注组的中位PFS分别为2.8个月和2.9个月,两者的ORR分别为11.8%和9.7%。皮下制剂的安全性也与静脉输注剂型一致。
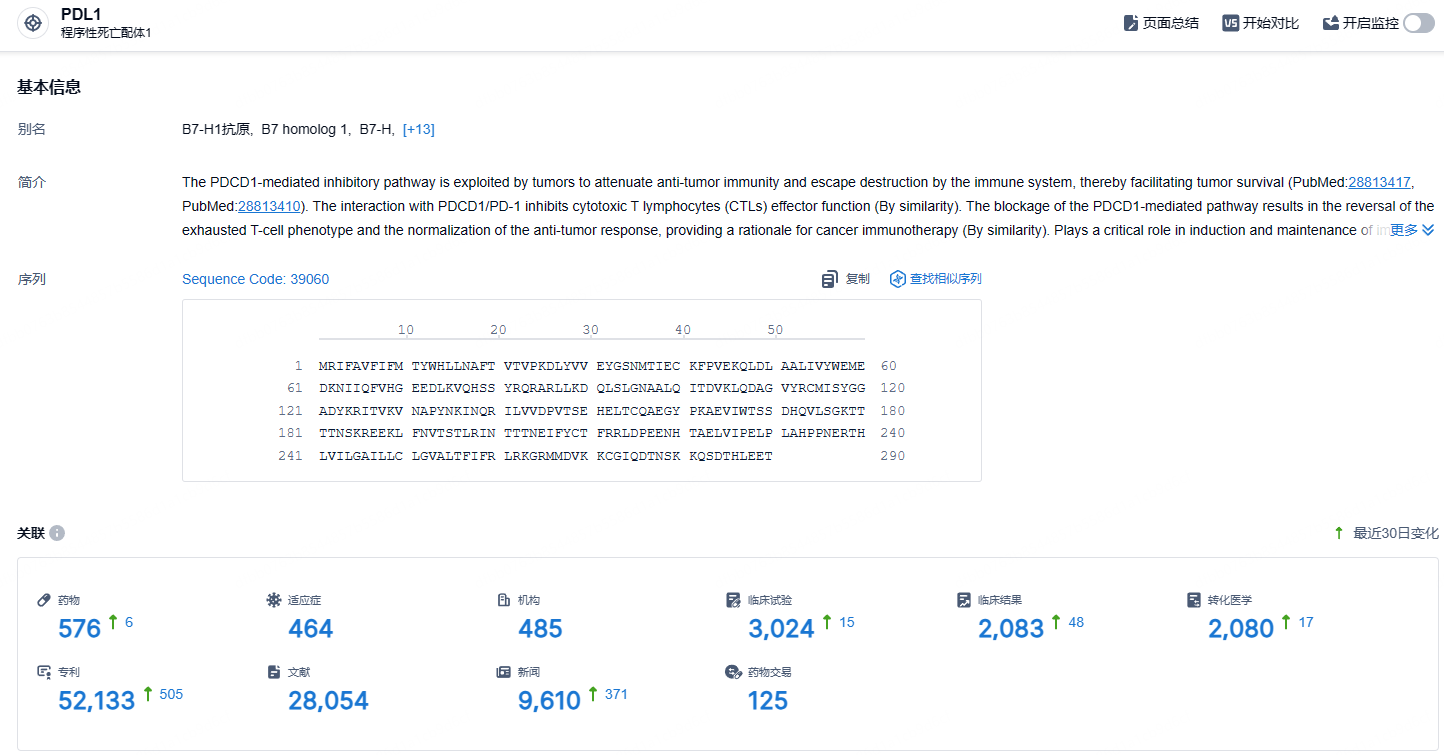
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月14日,PD-L1靶点共有在研药物576个,包含的适应症有464种,在研机构485家,涉及相关的临床试验3024件,专利多达52133件……阿替利珠单抗皮下制剂是罗氏第四种皮下癌症疗法。多项肿瘤学研究表明,与静脉给药相比,大多数癌症患者通常更喜欢皮下给药,因为其不适感较低、易于给药且治疗持续时间更短。新的给药方式的批准,有望使得阿替利珠单抗销售额获得提升。