尚健生物人源化抗CD38单抗SG301进入III期阶段,针对复发/难治性多发性骨髓瘤
近日,药物临床试验登记与信息公示平台显示,尚健生物的CD38单抗启动III期临床试验,成为首款进入III期阶段的国产CD38靶向药物。该研究是一项多中心、随机、双盲、安慰剂对照III期临床试验,旨在评估SG301联合泊马度胺和地塞米松对比安慰剂联合泊马度胺和地塞米松治疗至少接受过一线治疗的复发/难治性多发性骨髓瘤(R/R MM)患者的有效性和安全性。
SG301注射液(重组抗CD38人源化单克隆抗体注射液)是尚健生物自主研发的抗CD38人源化单克降抗体,主要通过Fc依赖性免疫效应机制杀死肿瘤细胞。此外,CD38抗体还可通过消除调节性细胞、调节性B细胞和髓样来源的抑制细胞来提高宿主抗肿瘤免疫力。SG301是具有独特抗原表位的抗CD38人源化单克隆抗体,与肿瘤细胞上的CD38特异性结合,通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、Fc受体介导Cross-linking诱导细胞凋亡以及抑制CD38环化酶活性等多种机制共同发挥抗肿瘤效应,SG301在临床前多种血液肿瘤模型中展现出良好的抗肿瘤活性。相比于已经上市的同靶点抗体药物,SG301在分子、细胞以及动物等层面均表现出更强的抑制肿瘤活性。

SG301于2020年10月率先获FDA批准并启动临床研究。2020年7月24日,SG301的新药临床试验申请(IND)正式获得CDE受理,适应症为血液肿瘤。尚健生物新闻稿表示,这是首个中国公司自主研发的CD38单抗申请临床,2023年4月22日,SG301的新药临床试验申请(IND)正式获得CDE受理,适应症为系统性红斑狼疮。此前,尚健生物开发的SG301注射液(静脉输注)临床适应症为多发性骨髓瘤,临床研究初步结果显示,SG301对比同类上市药物可在更低剂量下获得更深度的疾病缓解,且安全性更优,该剂型已于2023年11月进入I期阶段,针对系统性红斑狼疮(SLE)。
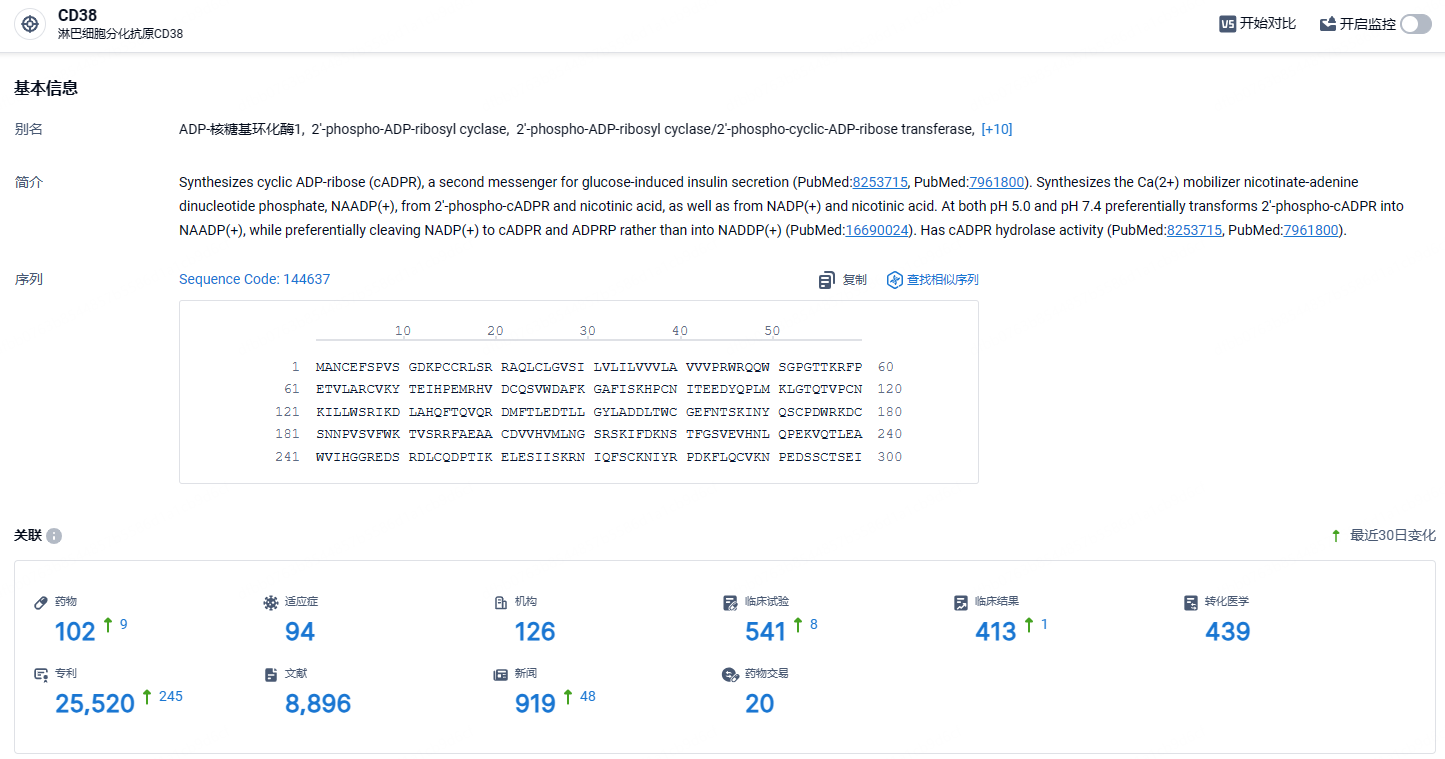
根据智慧芽新药情报库所披露的信息(点击下方卡片直达CD38靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年5月7日,CD38靶点共有在研药物102个,包含的适应症有94种,在研机构126家,涉及相关的临床试验541件,专利多达25520件……目前,全球已有两款抗CD38单抗获批上市,分别艾沙妥昔单抗赛诺菲)和达雷妥尤单抗(强生),其中后者的静脉注射剂型和皮下注射剂型均已获批上市。在中国,目前CD38抗体只有强生的达雷妥尤单抗(Daratumumab)获批上市,天境生物/HI-Bio的菲泽妥单抗和尚健生物的SG301正处于III期临床。期待SG301能够研发顺利,在CD38赛道脱颖而出。