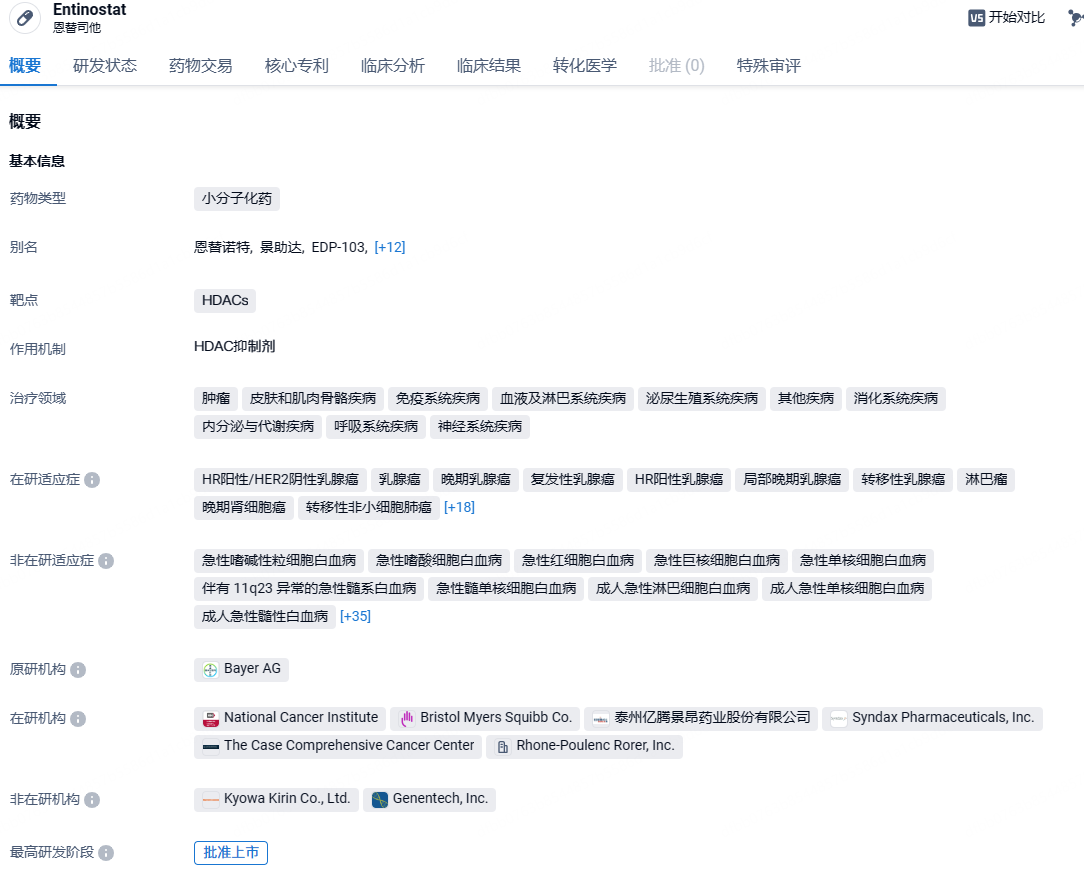
亿腾景昂首款创新药口服HDAC抑制剂恩替司他片获批上市,针对乳腺癌
2024年4月30日,国家药监局网站显示,亿腾景昂开发的1类创新药恩替司他片(商品名:景助达)新药上市申请获国家药品监督管理局(NMPA)正式批准,适应症为联合芳香化酶抑制剂用于治疗激素受体(HR)阳性、人类表皮生长因子受体-2(HER-2)阴性,经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。
恩替司他是一种组蛋白去乙酰化酶(HDAC)抑制剂,可选择性抑制I类和IV类HDACs,抑制细胞增殖、促进终末分化和/或诱导凋亡,发挥抗肿瘤作用。该药品上市为激素受体(HR)阳性、人类表皮生长因子受体-2(HER-2)阴性的局部晚期或转移性乳腺癌患者提供了新的治疗选择。恩替司他已经在全球数个国家开展了50余项临床研究,在超2000名癌症患者中评估了单药治疗或与其他药物联合治疗的安全性和有效性。此外,恩替司他片凭借半衰期较长的独特特性实现了一周一次的临床给药方式,极大的提高了患者服药依从性降低了患者用药成本。
2021年7月,在中国开展的恩替司他联合依西美坦治疗激素受体(HR)阳性、人类表皮生长因子受体2(HER-2)阴性晚期乳腺癌患者的随机、双盲、对照III期临床研究达到了预设的主要研究终点。结果显示,恩替司他联合依西美坦对比安慰剂联合依西美坦可以显著改善经内分泌治疗失败的HR阳性、HER-2阴性晚期乳腺癌患者的无进展生存期(PFS),差异具有统计学显著性,且安全性数据良好。
研究共入组了354例患者,中位年龄为52岁(范围28~75岁),ECOG 0分和1分的比例分别为53.7%和46.3%。大约31.9%的患者为原发内分泌耐药,38.7%的患者既往曾接受过解救化疗。大多数患者(68.9%)在基线存在内脏转移。组间的基线特征基本均衡。研究结果显示:恩替司他组的PFS较安慰剂组显著延长,疾病进展或死亡的风险降低24%,并且总生存期呈现获益趋势,死亡风险降低16.3%,绝经前或围绝经期患者从恩替司他联合方案的治疗获益与绝经后患者一致。研究的安全性数据与药物已知的安全性特征一致,部分血液学毒性发生率及严重程度低于同类药物。
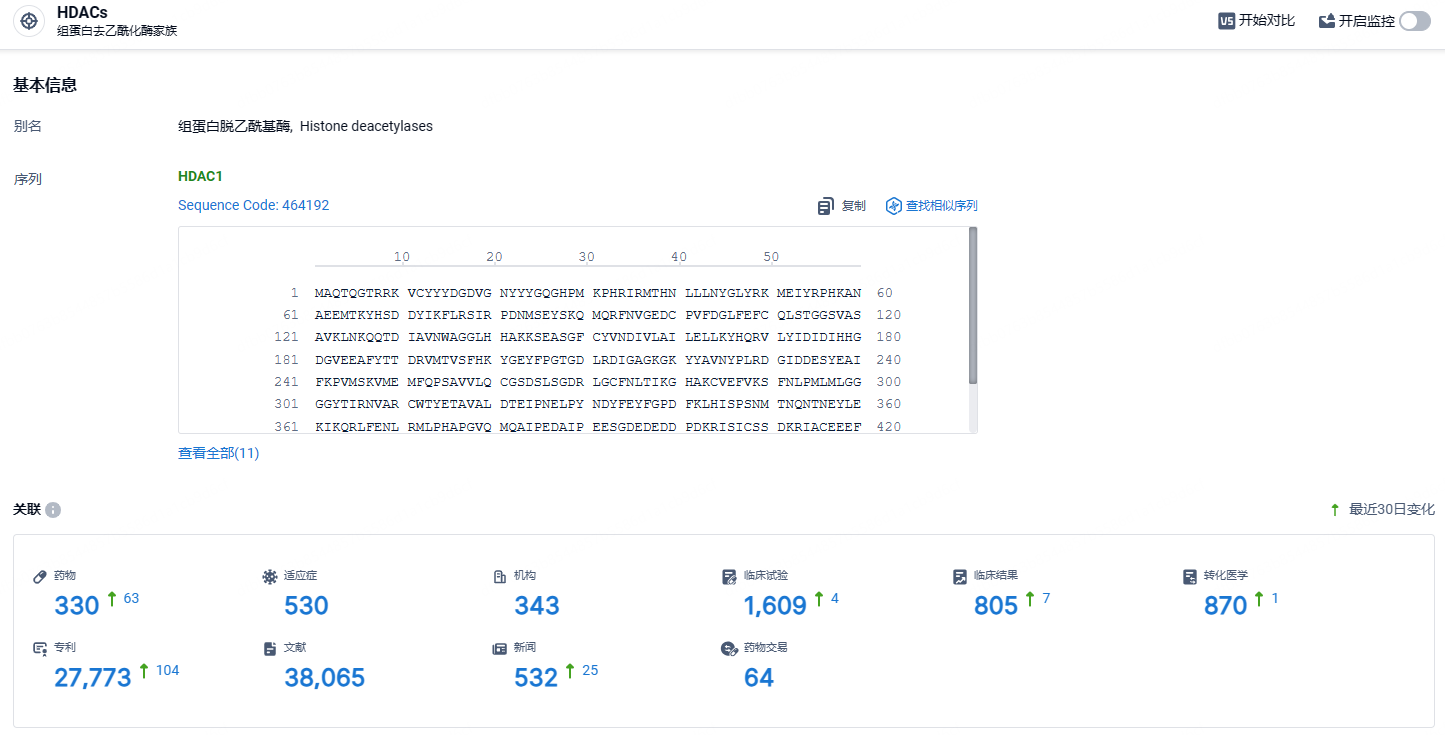
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达HDAC靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年5月1日,HDAC靶点共有在研药物330个,包含的适应症有530种,在研机构343家,涉及相关的临床试验1609件,专利多达27773件……恩替司他片凭借半衰期较长的独特特性实现了一周一次的临床给药方式,极大的提高了患者服药依从性降低了患者用药成本,使其进一步区分于其他HDAC抑制剂,具有成为“同类最优”的潜力。期待恩替司他后续商业化成功。




