RSV疫苗——百亿赛道终现曙光?
8月21日,辉瑞公司宣布,其ABRYSVO™疫苗已经获得美国食品药物管理局(FDA)的批准,可用于对32至36周孕妇进行接种以预防RSV感染导致的6个月以下胎儿出现的下呼吸道疾病(LRTD)和严重的LRTD。这是FDA首次批准母体疫苗。
今年,RSV领域相继迎来重大进展。GSK于5月4日发布公告,FDA已经批准arexvy疫苗上市,预防60岁及以上人群的RSV感染引发的下呼吸道疾病。辉瑞也在6月6日宣布,其RSV疫苗Abrysvo获得FDA的许可,用于防止此类疾病在60岁及以上的人群中扩散。7月17日,由赛诺菲和阿斯利康公司研制的单克隆抗体药物尼塞韦单抗,获得FDA的许可,用于预防所有婴儿人群RSV相关的下呼吸道疾病。这是针对婴儿全人群的首款RSV疫苗。
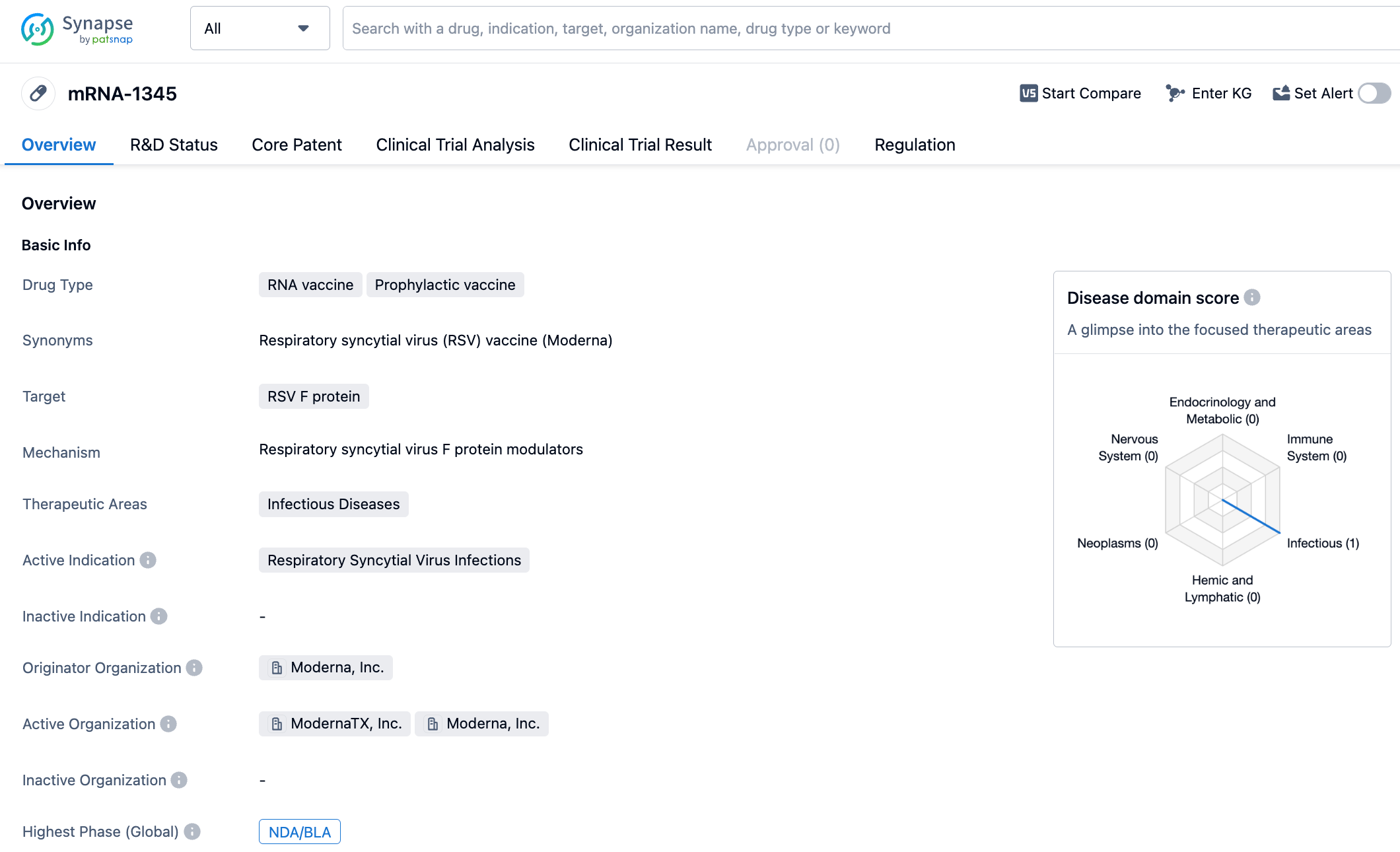
在其他大型药企中,基于mRNA技术的莫德纳公司的RSV疫苗,也有望快速拿到批准。7月5日,莫德纳宣布,他们的RSV疫苗mRNA-1345已经向多个全球监管机构提交许可申请,其中包括提交给FDA的生物制品许可证申请。早些时候,莫德纳发布的数据显示,他们的mRNA-1345在预防老年人RSV感染的III期临床试验中,达到主要终点。根据数据,这种疫苗对于有两种及以上RSV-LRTD症状的人的保护效果达到了83.7%,而对于有三种或以上症状的人则达到了82.4%。
RSV疫苗研发历史
呼吸道合胞病毒(RSV)是一种感染人类呼吸系统的病毒,主要影响婴儿、幼儿和年长的人群,特别是不足6个月的新生儿,免疫功能弱以及有慢性疾病的个体。RSV能够引发儿童的呼吸道疾病,如肺炎和支气管炎等。它是全球存在的儿童呼吸道感染的主要病原之一。RSV的症状可能十分复杂,包括发热,咳嗽,流鼻涕等,严重时,可能触发危险的生命状况,如呼吸短促,暂时停止呼吸,皮肤发青等。
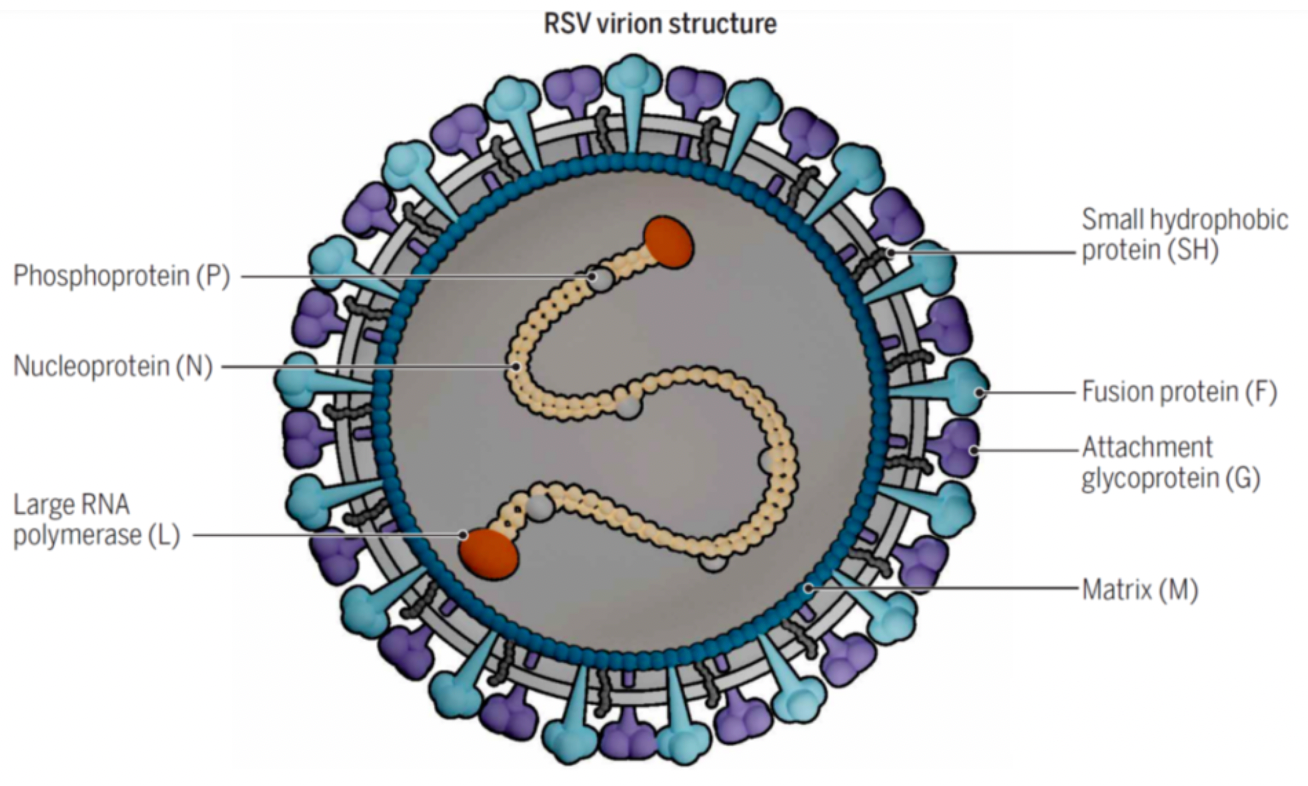
RSV的基因组是非节段性的单股负链RNA,基因组长度约为15.2kb,编码11种蛋白质,这里包括8种结构蛋白(F、G、M2-1、M2-2、 SH、N、P、L)和 3种非结构蛋白(NS1、NS2、NS3)。融合蛋白(F)和粘附蛋白(G)是两个主要的包膜糖蛋白。F是一种标准的I型糖蛋白,经过细胞蛋白酶的切割,可以分裂成F1和F2,进而具有生物活性,能促使病毒包膜与宿主细胞膜融合,形成多核巨细胞。G蛋白是 II型糖蛋白,能与宿主细胞膜的受体相结合,帮助病毒侵入宿主细胞。和G蛋白对比,F蛋白变异性低,相对更加稳定,因此是药物开发的重要靶点。
在1956年,就从黑猩猩的呼吸道中分离出RSV病毒,然而直至2013年,所有的RSV疫苗都是基于后融合F蛋白(Post-F)研发的,这可能是疫苗无法成功的一大原因。在此之后,疫苗研发的策略和类型瞬间扩增。
为了保持pre-F蛋白的稳定性,研究人员在蛋白质中加入了一个关键的化学键,就如同双面胶带,确保蛋白质能够折叠成pre-F的形态。
正因为对pre-F蛋白的改良,使得pre-F抗原疫苗成为可能,也将RSV疫苗的成功推进了一步。
莫德纳的RSV疫苗——mRNA-1345
Moderna的RSV疫苗mRNA-1345是一款编码病毒融合前F糖蛋白的mRNA疫苗,和融合后的状态比较,它能产生更好的中和抗体反应。该疫苗采用的是与Moderna COVID-19疫苗一样的脂质纳米粒子。F糖蛋白位于病毒表面,帮助病毒入侵宿主细胞来传播病毒。F糖蛋白有两种状态,即融合前和融合后。融合前构象是有效中和抗体的重要靶点,RSV-A和RSV-B亚型的蛋白序列非常相似。
此前,美国FDA已经给予mRNA-1345快速通道资格和突破性疗法认证,以便帮助60岁及以上的成年人预防RSV。
在2023年的一月份,Moderna发布了mRNA-1345三期临床试验结果,数据表明,研究结果已成功达到了主要终点,其对于预防60岁及以上人群的RSV相关下呼吸道疾病具有83.7%的效力;在安全性方面,此药品耐受性好,并未发现潜在的安全问题。其常见的副作用一般为轻度或中度程度,包括了注射处疼痛、感到疲劳、头疼、肌肉酸痛以及关节疼痛等。同月,FDA将突破性疗法的称号授予mRNA-1345,其用途是为预防60岁以上人群患上RSV-LRTD。预计在今年,该疫苗将可能获得正式批准并投入市场,为RSV感染的治疗提供新的选择。
RSV疫苗经过了60多年的曲折研发后终于看到了希望,这个百亿美元的市场,风口终于到来。