礼来GIPR/GLP-1R双受体激动剂tirzepatide在华申报上市,瞄准千亿减重市场
2023年8月21日,CDE官网显示,礼来的葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂Mounjaro(tirzepatide,替尔泊肽)新适应症申报上市,用于在低热量饮食和增加运动基础上改善成人肥胖或伴有至少一种体重相关合并症的超重患者长期体重管理。
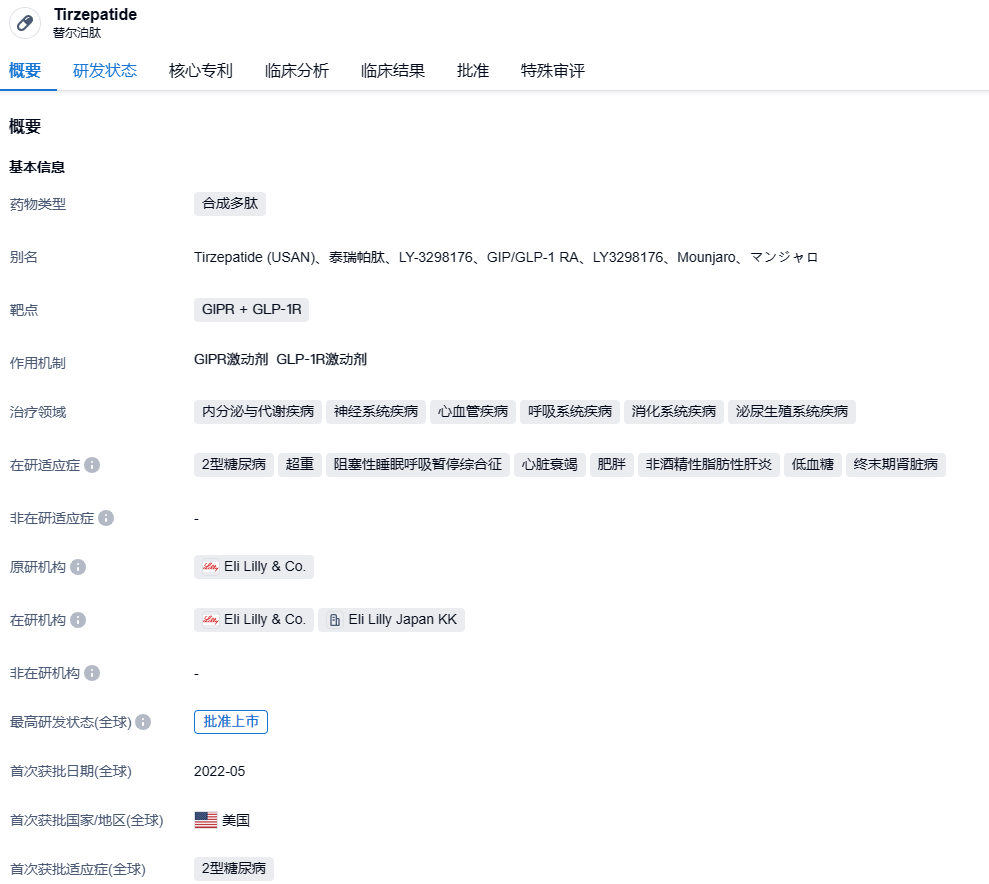
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂,曾在大型 III 期临床中头对头击败司美格鲁肽,也是首个且目前唯一获得全球批准的GIP/GLP-1受体激动剂。2022年5月,该药获得美国FDA批准(商品名:Mounjaro),用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。Tirzepatide上市后放量速度远超之前的度拉糖肽和司美格鲁肽,今年上半年销售额15.48亿美元,预计全年或超过40亿美元。减肥适应症方面,礼来在美国进行了4项三期临床,全部取得成功。今年4月,礼来向FDA递交了Tirzepatide减肥适应症的上市申请,并使用了一张优先审评券,将审评时间从10个月缩短到6个月。
2023年7月28日,礼来(Eli Lilly and Company)公布其葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂tirzepatide在两项3期试验SURMOUNT-3和SURMOUNT-4中的积极结果。分析显示,tirzepatide在两项试验中达到所有主要和关键次要终点。肥胖或超重成人患者(伴有不包含2型糖尿病的体重相关共病)在强化生活方式干预并接续使用tirzepatide治疗后,平均体重下降达26.6%。
SURMOUNT-3试验中,在12周强化生活方式干预导入期(包括低热量饮食、运动和每周咨询会议)后,体重下降至少达5%的患者被随机分配接受tirzepatide或安慰剂治疗72周,以评估药物的疗效和安全性。在72周双盲治疗期间,tirzepatide达两个共同主要终点,证明药品相对于安慰剂的优效性。接受tirzepatide治疗的患者自随机化后体重平均减轻21.1%(共同主要终点),而接受安慰剂治疗的患者在72周内平均体重则增加3.3%,药物组患者相对安慰剂治疗的净体重变化为-24.5%。此外,94.4%的tirzepatide组患者在随机化后达成额外≥5%的体重下降(另一个共同主要终点),此数值在安慰剂组仅为10.7%。在次要终点分析中,接受tirzepatide治疗的受试者自入组起经过12周强化生活方式干预,以及接续使用tirzepatide治疗72周后,总平均体重减轻达26.6%。
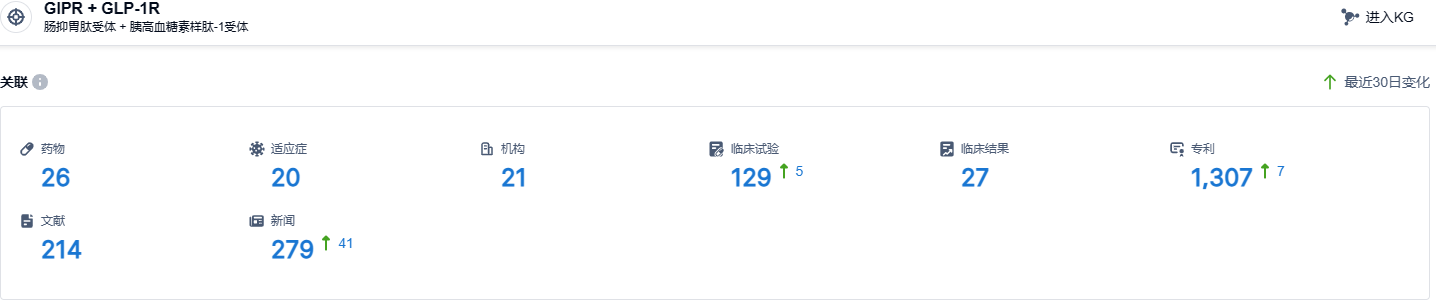
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 GIPR + GLP-1R 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月23日,GIPR + GLP-1R靶点共有在研药物26个,包含的适应症有20种,在研机构21家,涉及相关的临床试验129件,专利多达1307件……tirzepatide临床试验数据优秀,在降糖和减重领域具有非常大的市场潜力,该药有望成为破百亿美元销售的重磅品种。