鞍石生物c-Met抑制剂伯瑞替尼获批新适应症,治疗脑胶质瘤
2024年4月23日,中国国家药监局(NMPA)官网最新公示,鞍石生物旗下全资子公司浦润奥生物申报的伯瑞替尼肠溶胶囊新适应症上市申请获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,该药此次获批的新适应症为:用于治疗经放疗和替莫唑胺(TMZ)治疗后复发或不可耐受的,具有PTPRZ1-MET(ZM)融合基因的异柠檬酸脱氢酶(IDH)突变型WHO 4级星形细胞瘤或既往有较低级别病史的胶质母细胞瘤(GBM)成人患者。
伯瑞替尼(bozitinib)是针对c-Met的单靶点小分子靶向药物。该产品在多种临床前MET异常的人类胃癌、肝癌、胰腺癌和肺癌细胞移植动物模型(CDX)和人源肿瘤移植小鼠模型(PDX)中显示出良好的抑制肿瘤作用。伯瑞替尼肠溶胶囊在中国的开发权由浦润奥生物拥有。2021年12月,鞍石生物宣布完成对浦润奥生物的收购,从而将伯瑞替尼纳入了其研发管线。在中国大陆、香港及澳门地区以外的其它地区,伯瑞替尼的开发权益归冠科美博(Apollomics)所有。2023年11月,伯瑞替尼肠溶胶囊首次获批上市,适用于具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。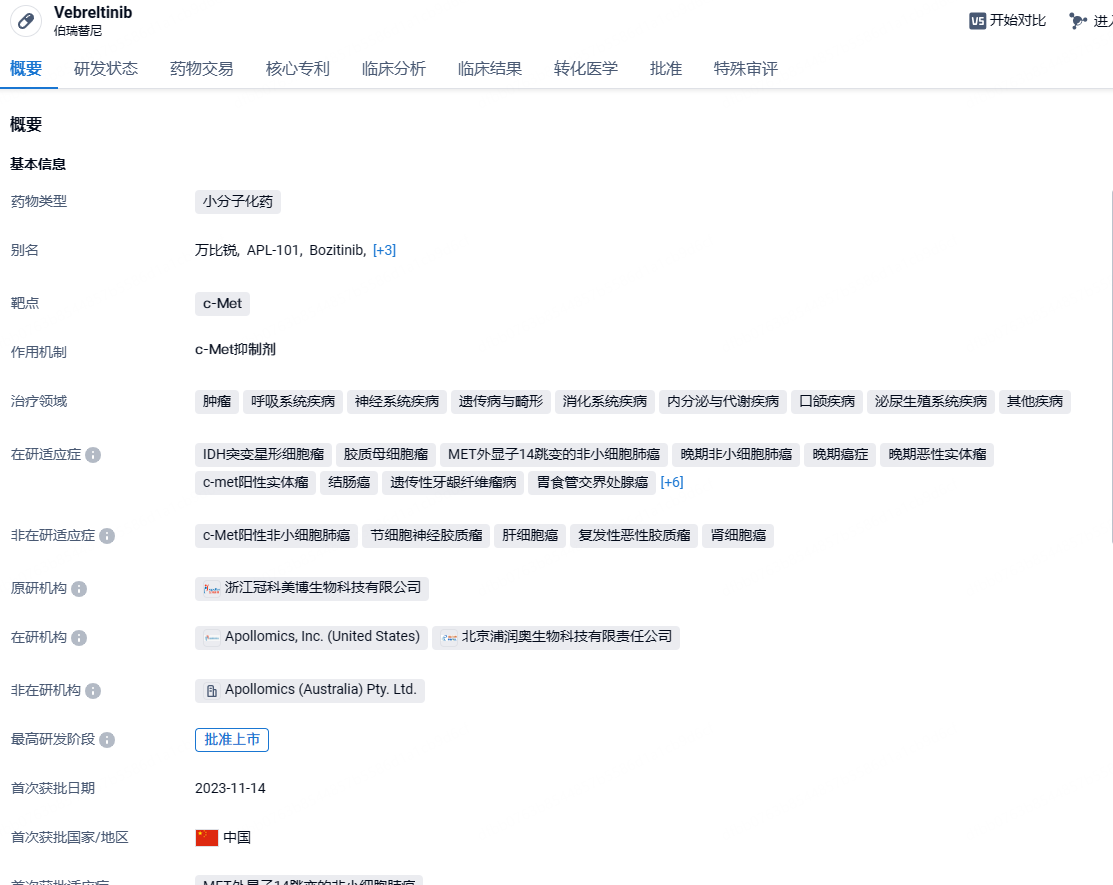
伯瑞替尼此次获批ZM融合阳性的脑胶质瘤适应症,是基于FUGEN研究(NCT06105619)的积极结果。FUGEN研究是一项随机、对照、开放、多中心临床注册Ⅱ/Ⅲ期研究,由首都医科大学附属北京天坛医院江涛院士团队领衔。截至2023年12月,研究共纳入84例患者。这项随机对照研究对比了伯瑞替尼与替莫唑胺剂量密度方案或依托泊苷+顺铂方案的安全性和有效性,其结果显示:相较于替莫唑胺剂量密度方案或顺铂联合依托泊苷方案,伯瑞替尼单药方案mOS为 6.31个月,对照组为3.38个月,降低48%的死亡风险,可显著改善ZM融合脑胶质瘤患者生存。整体安全耐受,常见不良反应多为1-2级,可通过临床管理恢复。
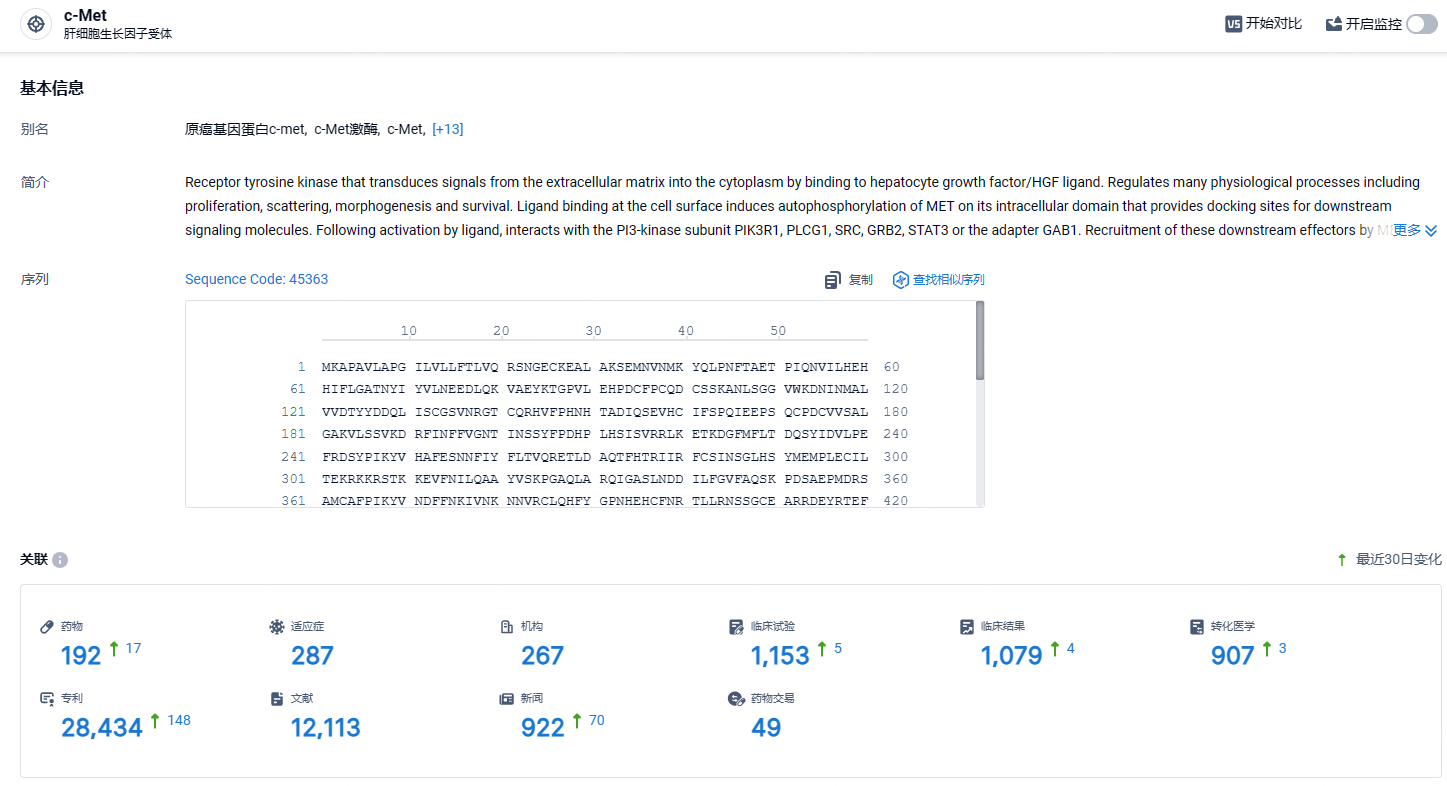
根据智慧芽新药情报库所披露的信息 (点击下方图片直达c-Met靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月25日,c-Met靶点共有在研药物192个,包含的适应症有287种,在研机构267家,涉及相关的临床试验1153件,专利多达28434件……时隔仅5个月,伯瑞替尼第二个脑胶质瘤适应症获批上市,用于既往治疗失败的具有PTPRZ1-MET融合基因的IDH突变型星形细胞瘤(WHO 4级)或有低级别病史的胶质母细胞瘤成人患者,这是鞍石生物在c-Met“泛瘤种”治疗领域的又一里程碑。期待伯瑞替尼后续商业化顺利。




