武田α4β7单抗维得利珠单抗皮下注射剂获FDA批准,治疗克罗恩病
2024年4月18日,武田宣布维得利珠单抗(vedolizumab,商品名:Entyvio)的皮下注射(SC)剂型获FDA批准新适应症,用于作为中度至重度活动性克罗恩病(CD)成人患者在接受维得利珠单抗静脉注射(IV)剂型的诱导治疗方案后的维持治疗方案。此次批准是基于III期VISIBLE 2研究的积极结果。
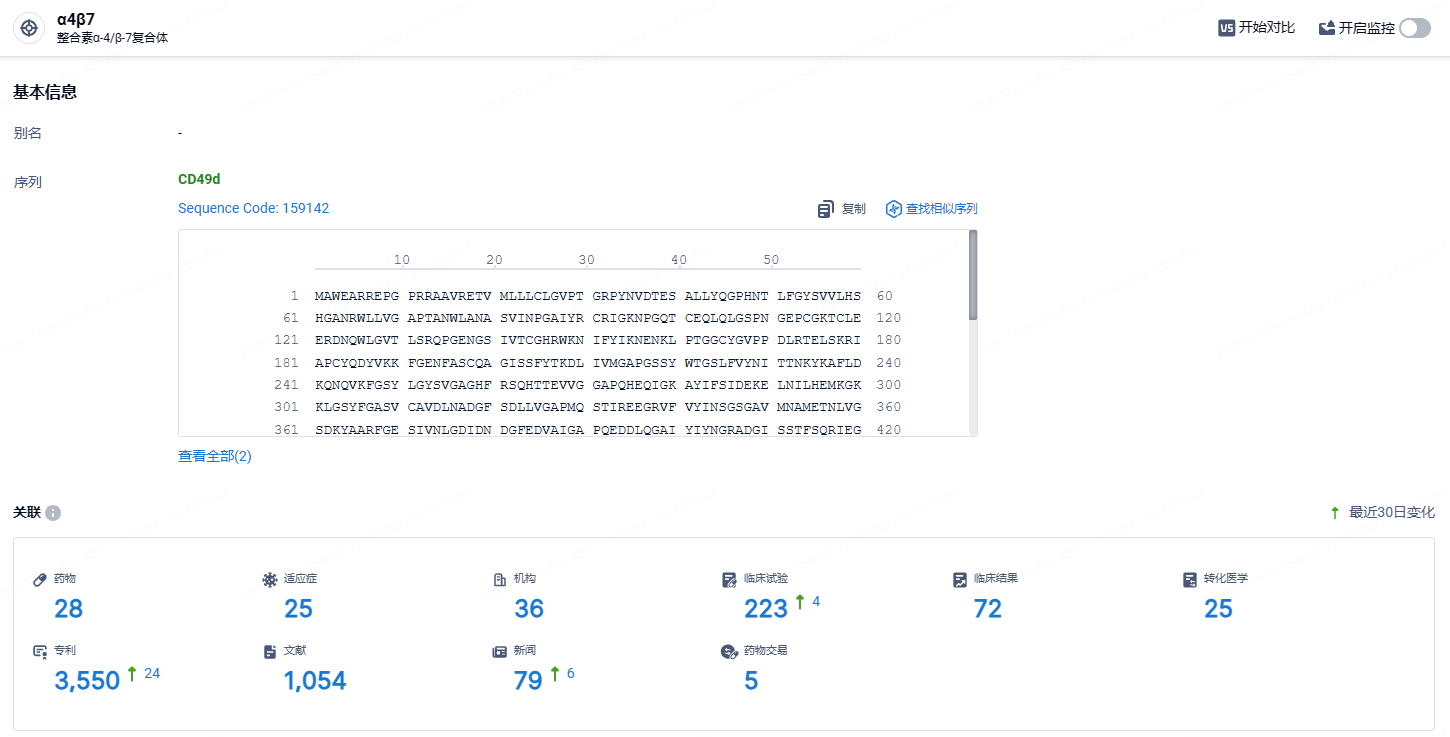
维得利珠单抗(Vedolizumab,VDZ)是抗 α4β7整合素的重组全人源化 IgG1单克隆抗体,特异性阻断 α4β7 整合素与肠道血管内皮细胞表达的黏膜地址素细胞黏附分子 1(MAdCAM-1)的结合,从而阻止T淋巴细胞从血管中迁移至肠黏膜,减轻肠道局部炎症反应。维得利珠单抗IV剂型和SC剂型分别于2014年5月和2020年4月首次获批上市。维得利珠单抗在中国获批的适应证为对传统治疗或肿瘤坏死因子α(TNFα)抑制剂应答不充分、失应 答或不耐受的中度至重度活动性成年克罗恩病(Crohn’sDisease,CD)和溃疡性结肠炎(ulcerativecolitis,UC)患者。
此次批准是基于III期VISIBLE 2研究的积极结果。该研究是一项随机、双盲、安慰剂对照临床试验(n=410),评估了维得利珠单抗(SC)维持治疗中度至重度活动性CD成人患者的安全性和有效性。入组患者至少对皮质类固醇、免疫调节剂(硫唑嘌呤、6-巯基嘌呤或甲氨蝶呤)或肿瘤坏死因子(TNF)阻滞剂其中一种药物应答不佳、无应答或不耐受,并在第0周和第2周接受了两次开放标签维得利珠单抗(IV)治疗,且在第6周产生临床应答(即患者的CD活动性指数(CDAI)评分相比基线降低70分)。研究的主要终点是第52周实现临床缓解(即CDAI评分≤150分)的患者比例。结果显示,在完成双盲期治疗的409例患者中,维得利珠单抗(SC)组患者实现长期临床缓解的比例显著高于安慰剂组(48% vs. 34%;p<0.01)。安全性方面,维得利珠单抗(SC)的数据与既往研究基本一致,但增加了注射部位反应。
根据智慧芽新药情报库所披露的信息 (点击下方图片直达α4β7靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月20日,α4β7靶点共有在研药物28个,包含的适应症有25种,在研机构36家,涉及相关的临床试验223件,专利多达3550件……维得利珠单抗是唯一得到FDA批准维持治疗溃疡性结肠炎的可供选择静脉注射或皮下给药的药物,根据不同的医疗需求、环境和个人偏好,帮助患者获得更好的治疗效果。