礼来GIP/GLP-1受体激动剂替尔泊肽3期试验积极结果公布,治疗打呼噜
2024年4月18日,礼来(Eli Lilly and Company)宣布SURMOUNT-OSA项目中两项临床3期试验的积极结果。分析显示,该试验达成主要终点与所有关键次要终点。与安慰剂相比,其葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂tirzepatide可显著改善中重度阻塞性睡眠呼吸暂停(OSA)肥胖患者的打呼情况,无论患者是否佩戴通气装置治疗。根据此积极结果,礼来计划递交相关监管申请。
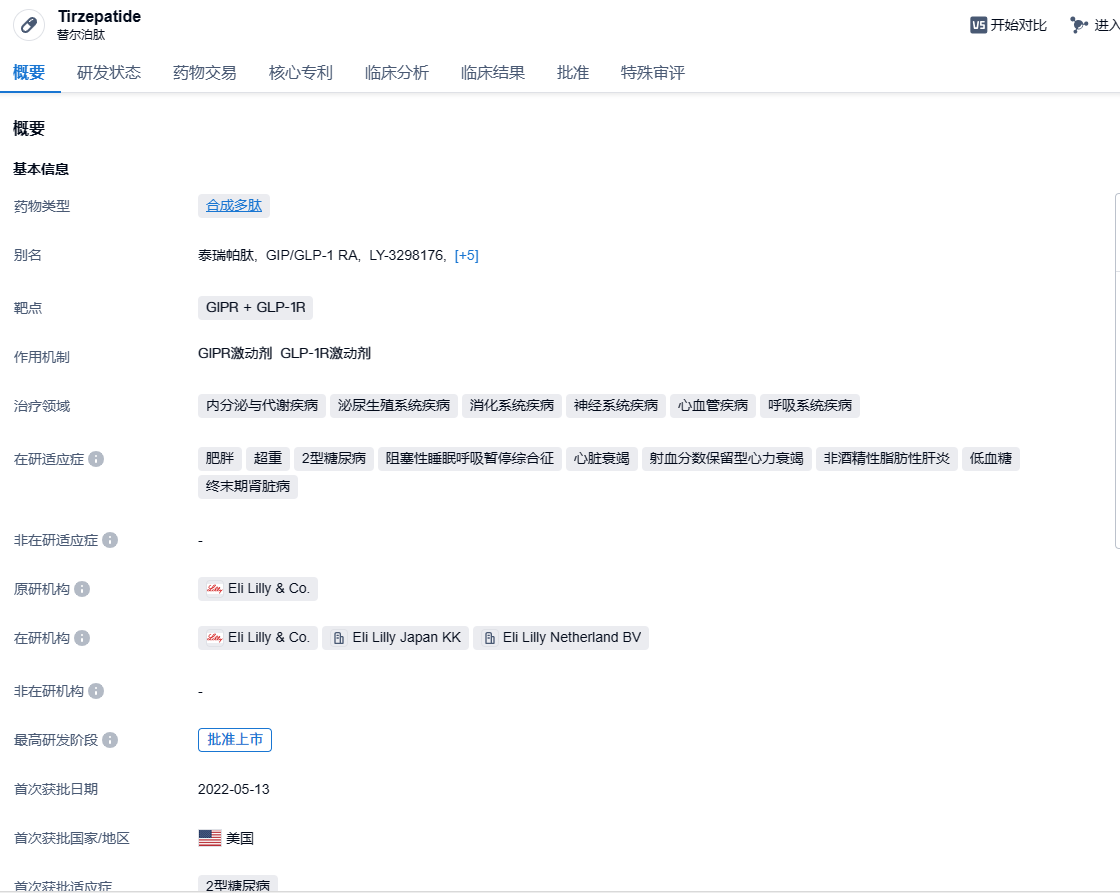
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂,曾在大型 III 期临床中头对头击败司美格鲁肽,也是首个且目前唯一获得全球批准的GIPR x GLP-1R受体激动剂。2022年5月,该药获得美国FDA批准(商品名:Mounjaro),用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。Tirzepatide上市后放量速度远超之前的度拉糖肽和司美格鲁肽,今年上半年销售额15.48亿美元,预计全年或超过40亿美元。减肥适应症方面,礼来在美国进行了4项三期临床,全部取得成功。2023年11月9日, Zepbound(tirzepatide)获美国FDA批准,用以使肥胖或超重成年患者减轻体重并保持体重稳定。这些患者患有体重相关共病,包含高血压、血脂异常、2型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病。
 SURMOUNT-OSA是一项多中心、随机、双盲研究,旨在检视每周一次皮下注射tirzepatide与安慰剂相比,在469位中重度OSA肥胖成年患者中的疗效和安全性。分析显示,两项研究皆达成主要终点。无论患者是否接受PAP治疗,tirzepatide皆显著改善中重度OSA肥胖患者的睡眠呼吸暂停症状。研究1评估tirzepatide在未接受PAP治疗患者中的作用。分析显示,在52周时,tirzepatide使患者的平均AHI较基线减少27.4次/小时,安慰剂则减少4.8次/小时。在关键次要终点方面,tirzepatide使患者的平均AHI较基线减少55.0%,安慰剂在此数值上为5.0%。
SURMOUNT-OSA是一项多中心、随机、双盲研究,旨在检视每周一次皮下注射tirzepatide与安慰剂相比,在469位中重度OSA肥胖成年患者中的疗效和安全性。分析显示,两项研究皆达成主要终点。无论患者是否接受PAP治疗,tirzepatide皆显著改善中重度OSA肥胖患者的睡眠呼吸暂停症状。研究1评估tirzepatide在未接受PAP治疗患者中的作用。分析显示,在52周时,tirzepatide使患者的平均AHI较基线减少27.4次/小时,安慰剂则减少4.8次/小时。在关键次要终点方面,tirzepatide使患者的平均AHI较基线减少55.0%,安慰剂在此数值上为5.0%。
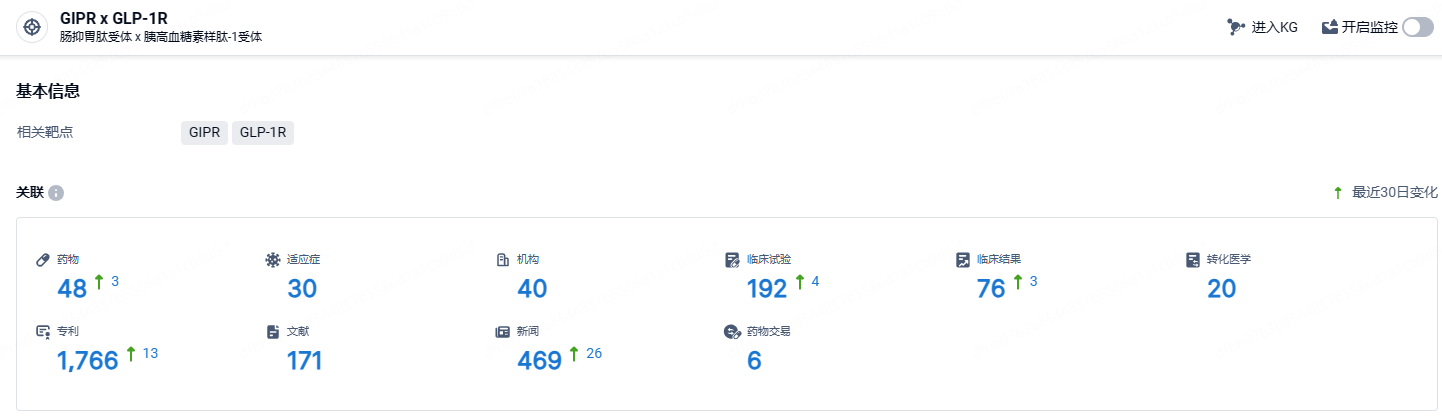
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GIPR x GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月27日,GIPR + GLP-1R靶点共有在研药物48个,包含的适应症有24种,在研机构28家,涉及相关的临床试验160件,专利多达1361件……tirzepatide临床试验数据优秀,在降糖和减重领域具有非常大的市场潜力,该药有望成为破百亿美元销售的重磅品种。目前还没有针对治疗OSA的药物获得批准,期待tirzepatide能够成功获批该新适应症。