预约演示
更新于:2025-05-07

Daiichi Sankyo Pharmaceutical (Shanghai) Co. Ltd.
更新于:2025-05-07
概览
标签
心血管疾病
免疫系统疾病
呼吸系统疾病
小分子化药
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 小分子化药 | 4 |
关联
6
项与 第一三共制药(上海)有限公司 相关的药物靶点 |
作用机制 FLT3抑制剂 |
最高研发阶段批准上市 |
首次获批国家/地区 日本 |
首次获批日期2019-06-18 |
作用机制 AT1R拮抗剂 [+1] |
在研机构 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2007-09-26 |
靶点 |
作用机制 ADRA1拮抗剂 |
在研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 日本 |
首次获批日期2006-01-23 |
10
项与 第一三共制药(上海)有限公司 相关的临床试验CTR20240177
评估受试制剂普伐他汀钠片(规格:40 mg)与参比制剂(PRAREDUCT®)(规格:40 mg)在健康成年参与者空腹和餐后状态下的单中心、开放、随机、单剂量、三周期、三序列、部分重复交叉生物等效性试验
主要试验目的:
研究空腹和餐后状态下单次口服受试制剂普伐他汀钠片(规格:40 mg,第一三共制药(上海)有限公司生产)与参比制剂普伐他汀钠片(PRAREDUCT®,规格:40 mg;Daiichi Sankyo Europe GmbH生产)在健康参与者体内的药代动力学特征,评价空腹和餐后状态口服两种制剂的生物等效性。
次要试验目的:
研究受试制剂普伐他汀钠片(规格:40 mg)和参比制剂普伐他汀钠片(PRAREDUCT®)(规格:40 mg)在健康参与者中的安全性
开始日期2024-03-07 |
申办/合作机构 |
CTR20140715
动态血压监测评价CS8663治疗原发性轻中度中国高血压患者的疗效及安全性的临床试验
以24小时ABPM监测评价CS8663 20/5 mg治疗原发性轻、中度中国高血压患者的疗效及安全性。
开始日期2014-10-30 |
申办/合作机构 |
JPRN-jRCT2080221540
Pharmacokinetic study of olmesartan medoxomil/amlodipine 20/5 mg tablet in Chinese healthy adult volunteers
开始日期2011-08-11 |
申办/合作机构 |
100 项与 第一三共制药(上海)有限公司 相关的临床结果
登录后查看更多信息
0 项与 第一三共制药(上海)有限公司 相关的专利(医药)
登录后查看更多信息
48
项与 第一三共制药(上海)有限公司 相关的新闻(医药)2025-04-16
·医药地理
引用本文曹 萌, 成 殷, 王佳静, 等.生物制品分段委托生产情形下的持有人质量管理体系关注点探讨[J].中国医药工业杂志,2025, 56(4): 552-558.DOI :10.16522/j.cnki.cjph.2025.04.018Discussion on the MAH’s Quality System in the Case of Contract Cooperative Manufacturing of Biological Products生物制品分段委托生产情形下的持有人质量管理体系关注点探讨曹 萌1,2,成 殷1,王佳静1,2,董正龙1,2,李香玉1,2*(1. 上海药品审评核查中心,上海 201210 ;2. 华东师范大学- 上海药品审评核查中心药品监管科学联合研究中心,上海 200241)摘要自药品上市许可持有人制度实施以来,随着生物技术的进步和临床需求的增长,生物制品分段委托生产模式受到了广泛关注。该模式可有效促进产业资源综合利用,加速生物医药研发成果转化,但考虑到委托生产的特定风险和生物制品的特殊性质,多生产地址质量管理、多受托方技术转移以及中间产品运输和放行等领域均存在一定挑战。本文通过梳理相关法规指南,分析生物制品分段委托生产的实际情况,探讨了持有人建立药品生产质量体系的关注点,并提出了针对性建议,希望有助于促进我国药品监管水平的提升和业界相关试点工作的开展。关键词持有人;委托生产;生物制品;分段生产;质量体系文章节选分段生产模式作为生物制品行业的创新生产策略,正逐步展现出其独特价值,受到了生物医药产业和监管部门在内的社会各界的高度关注。分段生产指将药品工艺的不同阶段,通过集团内协作或委托给合同生产组织(contract manufacture organization,CMO) 等方式,在不同的地址分别开展通常是将原液生产和制剂生产进行分段。分段生产在全球生物制品的生产实践中并不少见。例如,罗氏制药、第一三共制药等跨国制药企业的部分单抗或抗体偶联药物(antibody drug conjugate,ADC)等产品,在欧、美、日等地区已采用了该模式。为贯彻落实党的二十届三中全会对促进生物医药、医疗装备等产业发展的改革部署,在支持医药行业开放合作方面,应探索生物制品分段生产模式,并在部分地区开展创新和临床急需生物制品分段生产试点。上海目前已积极开展相关探索,部分品种进入注册申报阶段。在药品上市许可持有人制度下,生物制品分段委托生产模式有助于激发创新活力、促进生产资源的优化配置和高效利用;同时,专业化生产通过对生产流程的精细化管理,也有望推动技术创新和产业升级。生物制品分段委托生产模式客观存在的特定问题和盲区,给药品生产质量管理体系带来的潜在风险不容忽视,主要集中在多场地质量管理的协调统一、多方技术转移的充分完整和监督执行,以及原液或中间产品的合理运输和规范放行等方面。因此,针对B 证( 即代表委托生产的药品上市许可持有人)生物制品分段委托生产的情形,其质量管理体系的关注重点方面值得深入探讨。本文梳理了相关监管要求,探讨了质量管理体系的关注要点,并在高质量发展、提升全球竞争力方面进行了展望,期望为监管部门和业界开展相关工作提供一定的参考。扫描二维码阅读原文/登录官网查看了解更多文章信息作者简介:曹 萌(1983—),男,上海药品审评核查中心创新与监管科学发展部副部长、高级工程师,从事药品监管科学和相关数字技术的研究。通信作者:李香玉(1977—),女,上海药品审评核查中心副主任、高级工程师,从事药品检查和审评的研究。E-mail:lixiangyu@yjj.shanghai.gov.cn关于转载:原创内容未经允许,不得转载END欢迎订阅《中国医药工业杂志》《中国医药工业杂志》是我国医药工业领域中办刊历史最长的医药期刊,是由上海医药工业研究院主管,上海医药工业研究院、中国药学会和中国化学制药工业协会主办的全国性综合医药学术刊物,国内外公开发行。自1970年11月创刊以来,《中国医药工业杂志》 始终以报道我国医药工业和科研中的成果和经验为宗旨,刊载了大量反映中国医药工业发展水平的论文和论著,积累了丰富的第一手原始资料;同时密切关注国际上制药技术的发展新动向,刊登有指导意义的综述和专论。期刊订阅详情请登录《中国医药工业杂志》官网(http://www.cjph.com.cn)了解。《中国医药工业杂志》编辑部
抗体药物偶联物医药出海
2024-12-28
·医药速览
12月24号,阿斯利康和第一三共制药公司已自愿撤回在欧盟针对datopotamab deruxtecan(Dato-DXd)用于治疗成人局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的上市许可申请(MAA),这一决定基于TROPION-Lung01 III期试验的结果。
今年9月份,2024年国际肺癌研究协会(IASLC)世界肺癌大会上提出的TROPION-Lung 01研究(NCT04656652)的最终总生存(OS)分析结果,针对非小细胞肺癌(NSCLC)患者,使用针对TROP2的抗体药物偶联物(ADC)datopotamab deruxtecan(Dato-DXd)治疗与多西他赛相比,并没有显著提高总生存率(OS)。
这项开放标签研究的意向治疗(ITT)人群的结果显示,使用Dato-DXd的中位OS为12.9个月(95% CI,11.0-13.9),而使用多西他赛的为11.8个月(95% CI,10.0-12.8)(HR,0.94;0.78-1.14;P = .530)。在非鳞状NSCLC患者中,使用Dato-DXd的中位OS为14.6个月(95% CI,12.4-16.0),而使用多西他赛的为12.3个月(95% CI,10.7-14.0),这表示死亡风险降低了16%,但这一差异在统计学上并不显著(HR,0.84;95% CI,0.68-1.05)。与多西他赛相比,使用Dato-DXd的患者中3级或以上治疗相关不良事件(TRAEs)显著减少(分别为26%和42%)。
第一三共的MC-GGFG-DXD的linkerpayload应用于HER2(DAR 8)已经成功,后续在TROP-2(DAR 4), HER-3(DAR 8), B7H3(DAR 4), CDH6(DAR 8), MUC1(DAR 8)进行了套用,希望能想MC-VC-MMAE一样能有多个ADC成功,但是抗体和linkerpayload以及偶联和DAR值的组合是一个复杂的,不可以完全平移套用的公式。
但是Dato-DXD这就是完全失败了吗?并不是的,datopotamab deruxtecan在包括NSCLC、三阴性乳腺癌(TNBC)和HR阳性、HER2阴性乳腺癌开展了临床研究。肺癌就有七项III期试验和在乳腺癌中的五项III期试验,评估datopotamab deruxtecan作为单药治疗以及与其他抗癌治疗在各种环境中的联合治疗。成人局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)TROPION-Lung 01仅为其中一小部分。
TROPION-Breast01适应症是HR阳性/HER2阴性乳腺癌,6mg/kg Q3W给药,ORR显著优于化疗组(36.4% vs 22.9%),与SKB-264 5mg/kg药效类似,ORR36.8%;安全性方面,两组治疗相关不良事件(TRAEs)的发生率相当,但Dato-DXd组≥3级TRAEs发生率不到化疗组的一半(20.8% vs 44.7%),优于SKB-264 5mg/kg,TRAE(≥ Grade 3)为48.8%。
TROPION-Lung05治疗适应症为EGFR突变的非小细胞肺癌,用药剂量为 6 mg/kg Q3W,对于 EGFR 突变阳性患者,Dato-DXd 治疗的 cORR 为 43.6%;对 68 例携带 EGFR 敏感突变或 T790M 突变,且既往接受过奥希替尼治疗的患者,Dato-DXd 治疗的 ORR 高达 49.1%。安全性方面,47% 的患者治疗期间出现发生 ≥ 3 级不良事件(TEAEs),29% 的患者发生 ≥ 3 级治疗相关不良事件(TRAEs),仅有 1 例患者发生 ≥ 3 级药物相关间质性肺疾病(ILD)。总体而言,Dato-DXd 的安全性可控、可管理,研究中未出现新的安全性信号。
综上所述,目前datopotamab deruxtecan(Dato-DXd)失败的仅是局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)适应症方向,其他的适应症目前还在进行中。
往期链接
“小小疫苗”养成记 | 医药公司管线盘点
人人学懂免疫学 | 人人学懂免疫学(语音版)
综述文章解读 | 文献略读 | 医学科普 | 医药前沿笔记
PROTAC技术 | 抗体药物 | 抗体药物偶联-ADC
核酸疫苗 | CAR技术 | 化学生物学
温馨提示
医药速览公众号目前已经有近12个交流群(好学,有趣且奔波于医药圈人才聚集于此)。进群加作者微信(yiyaoxueshu666)或者扫描公众号二维码添加作者,备注“姓名/昵称-企业/高校-具体研究领域/专业”,此群仅为科研交流群,非诚勿扰。
简单操作即可星标⭐️医药速览,第一时间收到我们的推送
①点击标题下方“医药速览”
②至右上角“...” ③点击“设为星标
抗体药物偶联物临床3期临床结果临床失败
2024-12-17
·药时代
邀请函
INVITIAION
出海
既是面向蓝海的战略布局
也是走向大洋的深远抉择
发展机遇吹响了扬帆号角
而汹涌波涛则时时考验掌舵者的智慧与胆略
作为肩负创新使命的中国药企
该如何应对「出海」这道必答题?
NewCo模式及其他国际合作创新模式的正确认知,海外临床试验的设计关键,“走出去”实践能力的锤炼,乃至从跨国药企(MNC)视角洞察合作模式与需求,这些认知与能力维度正是迈向国际化的关键。掌握这些“硬核”能力,是确保“扬帆出海”一帆风顺的基础。
为此,我们诚挚邀请您参加“淬锋砺剑臻遥程——创新药企出海策略研讨对接会”,在这里我们汇聚产业促进机构、全球顶级MNC、资本、临床设计及BD资源,与您共话出海战略,助您在出海征程中脱颖而出!
活动价值
全球视野 深度解析
汇聚全球顶级资源,从资本、临床设计、MNC及BD角度探析创新药企出海关键环节
涵盖美国、日本等重点市场最新实践经验,助力药企深入理解全球化布局策略
聚焦应用 模式创新
剖析NewCo模式应用场景,探寻医药授权合作机遇
诠释“没有失败的临床试验,只有没有设计好的临床试验”,挖掘BD视角下的临床试验设计“关键成功要素”
价值协同 资源对接
重点海外市场上市注册工作的合规要点
探讨跨境资本对接与MNC合作模式,助力药企掌握从中国到全球的协同路径
互动交流 洞见未来
圆桌交流环节,深入BD交易、NewCo模式核心竞争力等热点议题
企业与专家充分互动,提供深度价值洞见
报名方式
扫描上方二维码,参与报名
主持人
洪涤
高岳生命科学集团
首席执行官
洪涤博士拥有超过二十年生物医药领域从研发创新到产业化、商业化的全产业链行业经验,在多家著名跨国药企,CRDMO和生物技术公司担任高管职务。曾就职于全球跨国药企罗氏(Roche)中国研发中心和礼来(Eli Lilly)中国研发中心,从事创新药研发工作,涉及中枢神经、代谢、肿瘤和病毒等多个疾病领域。此后,分别担任安进(Amgen)亚洲研发中心运营负责人及对外合作负责人,保诺桑迪亚科技集团(Bioduro-Sundia Group)中国区运营负责人、执行总监,以及华领医药 (Hua Medicine)运营及战略合作副总裁。2022年加入高岳生命科学集团并担任CEO。致力于整合全球科研及产业资源,通过构建生命科学“专业化园区载体”和“全生命周期产业生态服务”,打通从“源头创新”到“产业化”的通道,提高生物医药创新成果的产业化成功率,使高岳生命科学集团成为中国生命科学创新企业成果转化的理想伙伴。
参会嘉宾
王莉
海通证券股份有限公司
医疗健康行业组负责人
复旦大学金融学硕士,2009年加入海通证券投资银行部。任职期间,主导或参与智翔金泰IPO、禾元生物IPO、澎立生物IPO、益诺思IPO、辰光医疗IPO、之江生物IPO、中红医疗IPO、森麒麟轮胎IPO、海优新材IPO、三江购物IPO、天马科技IPO、厦门国贸可转债、厦门国贸2013年度配股、威海广泰再融资、界龙实业再融资、光明乳业非公开发行、平高电气非公开发行、交通银行非公开发行、三江购物非公开发行、天马科技可转债等项目。
李进
CGTA 理事长
上海高博肿瘤医院 院长
2016年7月受聘为上海同济大学附属东方医院肿瘤医学部主任,2023年10月起受聘为东方医院肿瘤医学部终身教授、东方-高博肿瘤研究所所长,上海高博肿瘤医院院长及首席科学家。李进教授具有近40年临床工作经验,精炼于肿瘤内科的综合诊治,牵头的I期抗肿瘤药物临床研究超过200余项,牵头II-III期临床试验近50项,最为突出的是2014年带领中国临床肿瘤团队完成了国际上第一个治疗胃癌的小分子抗血管靶向药物(阿帕替尼)的I-III期临床研究,并代表中国的团队出席ASCO大会做大会主题发言。李进教授牵头完成在中国上市新适应症的药物还有雷替曲塞、TAS-102、瑞戈非尼、斯鲁利单抗、西妥昔单抗、尼妥珠单抗等等。
邢天奇
NJS NeoVatio
创始人兼合伙人
邢天奇博士拥有复旦大学数学本科、内布拉斯加州林肯大学统计学博士和哥伦比亚大学MBA学位。邢博士在制药及CRO行业25年的新药研发经验,曾在第一三共制药和罗氏公司担任统计总监,领导了奥美沙坦及其复方药物的FDA注册审批工作。在NJS,他致力于为中小生物科技公司提供可获得FDA认可的癌症临床试验适应性设计,并带领团队帮助客户获得了六个癌症新药的FDA批准。凭借多年工作经验,邢博士在业界具有广泛的影响力,并担任了多个科学顾问委员会以及全球临床发展顾问委员会的成员。
刘苗苗
思尼特生物科技有限公司 董事长
神户医疗产业都市推进机构 中国区首席代表
在日本公益财团法人神户医疗产业都市推进机构医疗创新推进中心企划部任职,期间成功主导了17个新药项目的申报注册和临床工作,并在医疗转化中心推动了40个项目的顺利转化,展现了她在医疗领域的深厚专业能力和卓越的项目管理技巧。2018年,刘苗苗女士获得FBRI授权,成为中国区首席代表。2019年担任中日合资企业思尼特生物科技有限公司董事长一职,全面负责中日业务合作与拓展工作。其领导力和专业能力得到了业界的广泛认可:2020年,被任命为成都医药健康产业生态圈联盟副理事长;2021年,当选为成都双流区第十九届人民代表大会代表;2023年,荣任天府新区商会副会长。
沈蓉
辉瑞投资有限公司
中国业务发展转型负责人
沈蓉女士在医疗产业、投资及咨询领域拥有多年工作经验,现任辉瑞中国业务发展转型负责人。在加入辉瑞之前,她曾在晨兴创投等知名投资机构任职,从事创新药和新兴技术的投资,并于IQVIA等咨询公司任管理咨询顾问,为跨国药企和本土生物科技公司提供战略支持。沈蓉女士于中国科学技术大学获得化学专业学士学位,后于宾夕法尼亚大学获得生物化学博士学位。
沈志荣
百济神州 副总裁
全球转化研究及转化医学负责人
美国德州大学西南医学中心基础生物医学博士。师从美国科学院士王晓东博士,2010年在美国德州大学西南医学中心获得博士学位,在癌症机理和抗癌药物研发领域从业10余年,主要从事细胞凋亡、坏死及与肿瘤发生发展、耐药相关的机理研究,在Cell Chemical Biology, PNAS等国际期刊等刊物发表多篇论文。2011年加入北京生命科学研究所(NIBS),创建了代谢组学中心并担任中心主任。沈志荣博士曾主持参与省部级项目3项,曾任中国医疗保健国际交流促进会分会委员,获得北京人才项目、北京市科技新星、青年拔尖人才、中关村高端领军人才等荣誉。2015年加入百济神州从事创新药发现及转化医学研究。负责百济神州转化研究及转化医学、临床生物标志物、伴随诊断开发以及临床前抗肿瘤及免疫创新生物药项目研发等方向。
特邀嘉宾
本庶佑(视频致辞)
2018年诺贝尔生理学或医学奖获得者
京都大学大学院医学研究科 客座教授
(免疫基因体医学讲座)
本庶佑教授是日本著名免疫学家,主要从事癌症免疫疗法相关研究工作,为治疗癌症制造新药作出了显著的贡献,其先后获得美国国家科学院外籍院士、德国国家科学院院士、日本学士院会员等荣誉头衔。2018年,本庶佑教授因“通过抑制免疫的负调节信号来治疗癌症的方法”而与美国MD安德森癌症中心的James Allison共同获得诺贝尔生理学或医学奖。
田中纮一
田中医疗创造研究所 所长
京都大学 名誉教授
青岛大学 名誉教授
田中纮一教授是日本医学界的杰出人物,拥有丰富的医疗管理与临床研究经验。他曾担任京都大学医学院研究所教授及附属医院院长,并自2005年起成为京都大学名誉教授。在医疗管理领域,田中教授曾担任先端医疗振兴财团副理事长、先端医疗中心院长,以及神户国际医疗交流财团理事长。在国际合作方面,田中纮一教授曾作为新加坡中央医院(SGH)的高级顾问和客座专家,专注于移植和肝胆胰外科,以及中国青岛大学医学院附属医院名誉教授。田中教授的主要成就包括2004年移植亚洲终身成就奖、2014年日本学士院堂荣誉,这些荣誉彰显了其在医学领域的卓越贡献。目前,田中纮一教授在国际先端医疗咨询公司(IFMS)担任理事长等职。
活动须知
本次活动重点面向生物医药企业,诚邀创新药企高管、业务决策者或BD负责人,大型跨国药企高管或BD负责人,专注于新药研发的核心专业人士及相关负责人参会
报名信息提交成功后,我们将尽快审核,请您在3个工作日后前往报名页面查看最新结果
如有活动相关问题,敬请联系
UDC Consulting
张宇婕 商务咨询部 总经理
联系邮箱 zhangyujie@shftz.cn
联系电话 +86 136 6152 6591
免责声明
以上内容仅供参考,UDC及其关联公司和员工不对因您使用这些信息而获得的结果承担法律责任。
点击左下角阅读原文,参与报名!
高管变更ASCO会议
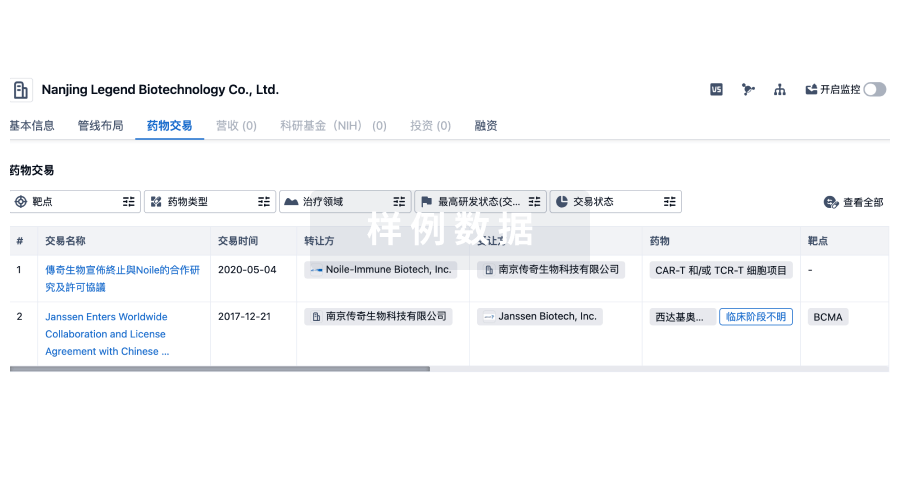
100 项与 第一三共制药(上海)有限公司 相关的药物交易
登录后查看更多信息
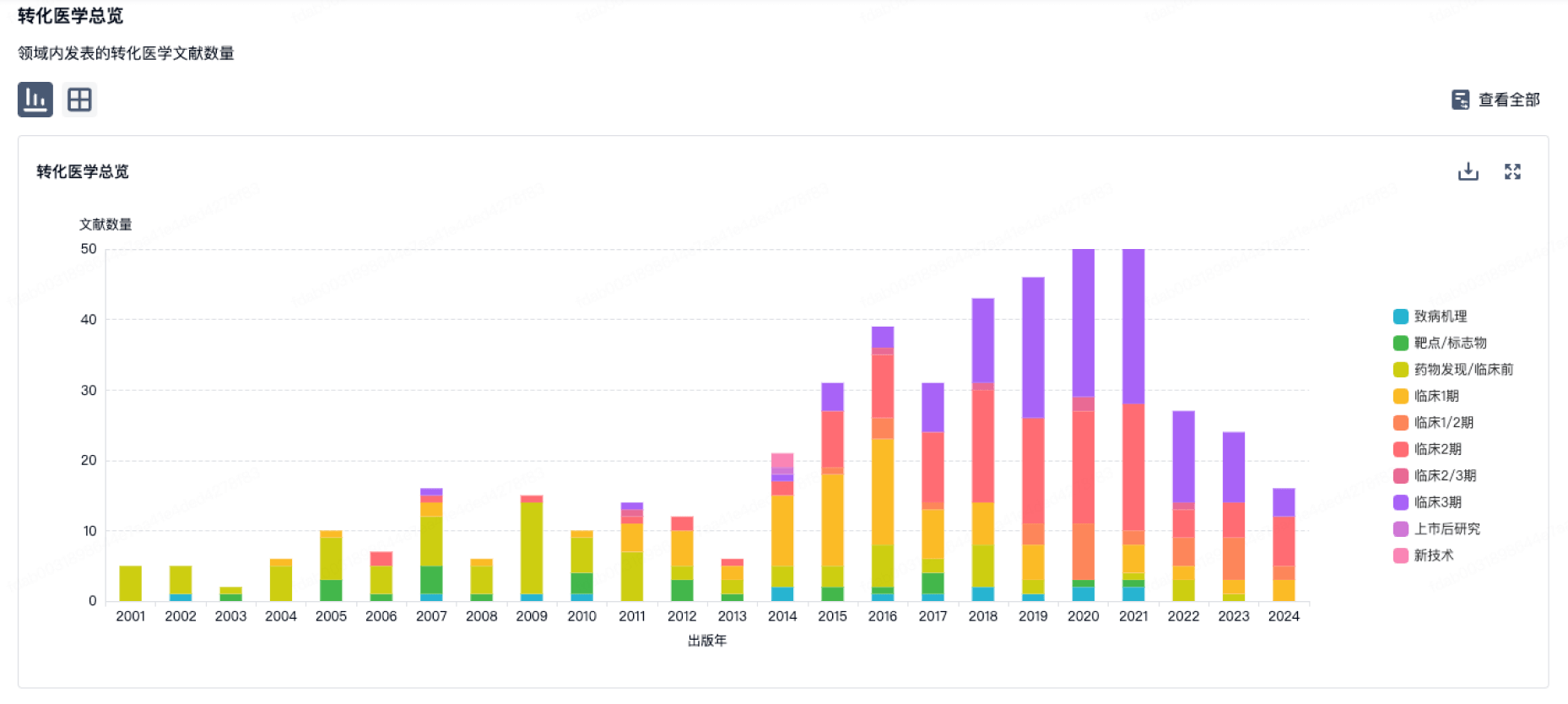
100 项与 第一三共制药(上海)有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年08月26日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
申请上市
1
3
批准上市
其他
2
登录后查看更多信息
当前项目
| 药物(靶点) | 适应症 | 全球最高研发状态 |
|---|---|---|
赛洛多辛 ( ADRA1 ) | 前列腺增生症 更多 | 批准上市 |
奥美沙坦酯氨氯地平 ( AT1R x VDCCs ) | 原发性高血压 更多 | 批准上市 |
盐酸甲氧那明/那可丁/氨茶碱/马来酸氯苯那敏 ( H1 receptor x cGMP-PDE x β2-adrenergic receptor ) | 哮喘 更多 | 批准上市 |
奎扎替尼 ( FLT3 ) | 肿瘤 更多 | 申请上市 |
奥美沙坦酯氢氯噻嗪 ( AT1R x NCC ) | 原发性高血压 更多 | 无进展 |
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
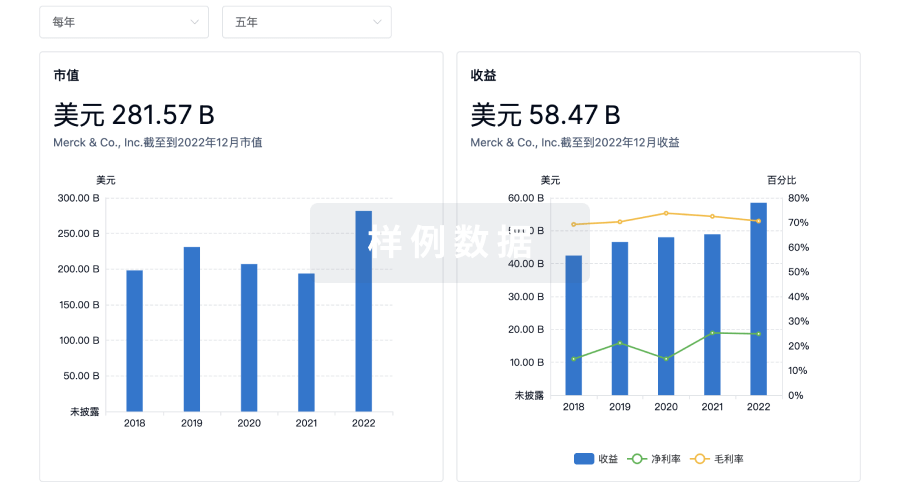
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
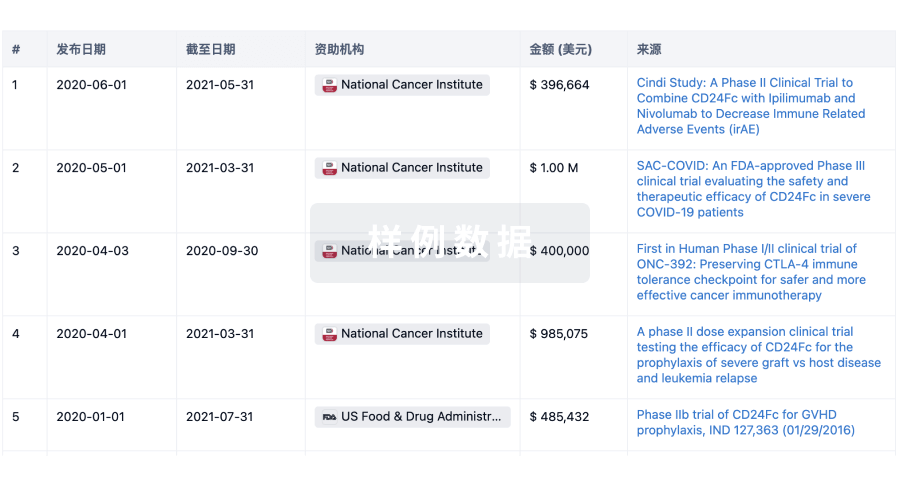
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用



