思路迪医药IPO,加速探索皮下注射PD-L1更便利给药方案 | 第一现场
2022-12-16
IPO临床2期临床结果申请上市
• 恩沃利单抗新增给药方案得到PK/PD、药物有效性及安全性三方面的数据支持。新增给药方案的过程,与FDA 肿瘤疾病办公室医学肿瘤学家 Mirat Shah此前在介绍Optimus项目时提到的方法类似。• 恩沃利单抗最早可能在2024年底到2025年底间在美国获批上市。• 除了单药研究外,恩沃利单抗已有多项联合用药研究计划,部分联用研究已经启动。12月15日,思路迪医药正式在港交所挂牌上市,首日交易收盘价31.45元,涨幅25.90%。该公司产品管线包含一款核心产品及11款候选药物,其中皮下注射PD-L1抑制剂恩沃利单抗PD-L1抑制剂恩沃利单抗是公司的支柱产品,于2021年11月获国家药监局上市批准。肿瘤治疗逐渐进入慢病化时代,药物使用的长期耐受性、依从性、便利性等,愈发受到重视。去年美国FDA推出肿瘤药剂量优化Optimus项目,希望药物在开发及上市后研究中,尽可能为患者探索最佳给药方案。因此,恩沃利单抗获批上市也特别受到市场关注。为进一步提高临床医生的用药灵活性及患者用药便利性,今年公司又对用药方案进行优化调整,在原先150mg每周一次给药(150mgQW)的基础上,新增300mg每两周一次给药方案(300mgQ2W),新方案近期也已获得监管批准。思路迪医药表示,待数据进一步积累,未来可能继续申请3周或4周一次给药方案。这是国内新药研发为数不多的上市后给药方案优化案例。
PK/PD+安全性+有效性支持新给药方案
思路迪医药首席战略官和首席医学官肖申博士提到,此次新增给药方案有三方面数据支持,包括药代动力学参数和剂量反应曲线 (PK/PD)、药物的有效性及药物的安全性数据。数据综合了恩沃利单抗在中国、美国、日本进行的多项临床研究结果。“我们给监管部门的证据首先是,不论两周还是一周给药一次,治疗周期内患者的血药浓度始终超过药物最低起效浓度;其次是,改变给药方案,不会对治疗的安全性和有效性产生影响。”肖申说。其中,血药PK/PD参数主要来自中国CN-001、美国US-001和日本JP-001这3项Ⅰ期临床研究。相对应的药物安全有效数据则来自于数个Ⅱ期和关键临床研究的数据。200多名患者的数据被纳入全面的综合分析比较,涵盖MSI-H/dMMR晚期实体瘤、晚期胆道癌及胃癌或胃食管交界处癌等多种肿瘤类型。3项Ⅰ期研究对多种剂量方案(0.01 mg/kg至10 mg/kg QW、2.5 mg/kg至5.0 mg/kg Q2W及300 mg Q4W)展开探索。结果显示,采用不同给药间隔都可能实现恩沃利单抗血药浓度在给药周期内的谷值远大于起效浓度5μg/mL。因此Ⅰ期研究得出结论,恩沃利单抗2.5mg/kg QW、150mg QW及5.0mg/kg Q2W(若体重为60kg,相当于300mg/Q2W)剂量水平,均为合理给药方案,可用于后续临床试验。
Preview
来源: 研发客
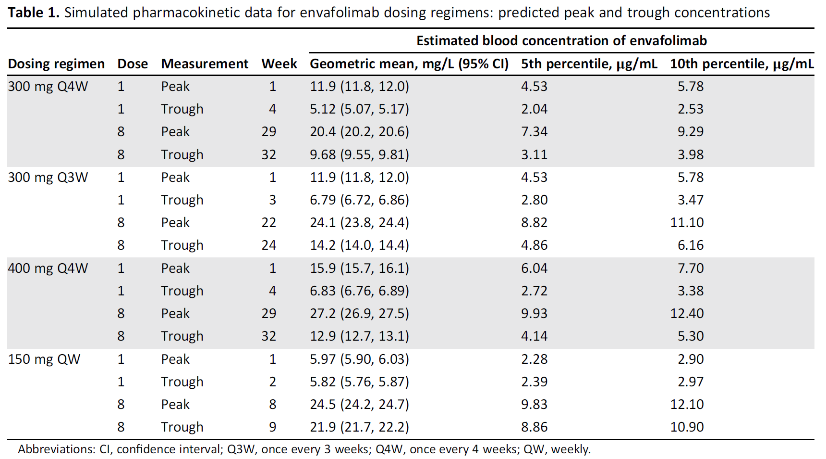
恩沃利单抗I期临床US-001采用多种给药方案,血药浓度谷值均大于5 μg/mL。
从上表可见,即使采用300mgQ3W或400mgQ4W用药方案,仍有90%以上患者的血药浓度谷值保持在5μg/mL以上,据该研究发表论文所述,比最低起效浓度(0.5μg/mL)高出10倍。安全性和有效性证据以3项Ⅰ期研究,及采用150mgQW 用药方案的MSI-H/dMMR适应症关键临床研究为基础,随后开展的拓展队列Ⅱ期研究数据与前几项对照,证明采用300mgQ2W,疗效及安全性与150mgQW没有差别。肖申提到,目前恩沃利单抗正在国内进行的多项临床研究,如CN005、CN006、CN011、CN012等,都是采用每两周一次或每三周一次的给药方案。“在递交给监管机构的材料中,我们就不同用药方案的安全性和疗效进行比较,没有发现新方案在安全性和有效性方面有明显差异。”根据此前公布的数据,恩沃利单抗在Ⅰ期研究中安全性良好,未发生剂量限制性毒性(DLT)及5级不良反应,也未发现预计之外的安全信号。
Preview
来源: 研发客
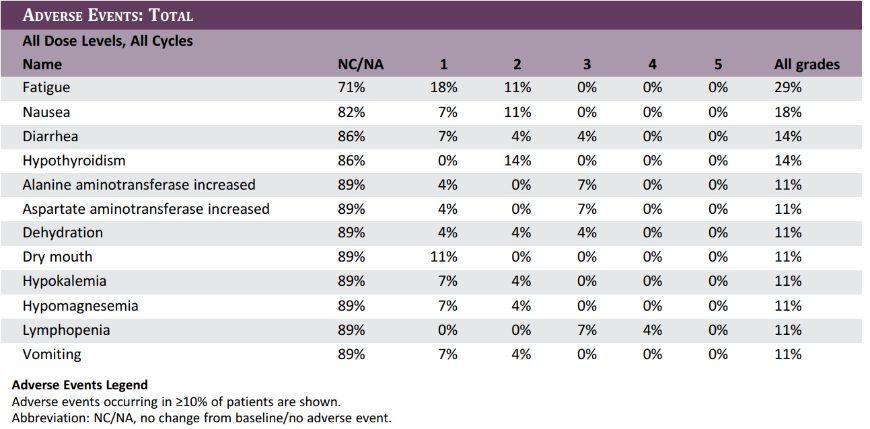
恩沃利单抗Ⅰ期临床研究US-001不良反应发生情况
而此前一项采用5.0 mg/kgQ2W给药,针对晚期胃癌或胃食管交界处癌一线治疗的探索性II期临床研究,也公布过安全性数据。在15名接受治疗的受试者中,出现3-4级TEAE为73.3%。最常见的3-4级TEAE包括中性粒细胞数减少46.7%,白细胞数减少20.0%,贫血20.0%及血小板数减少20%,未发生5级TEAE。这些发现和每周给药以及和同类药物相比,均未发现有明显差别。疗效方面,在采用150mgQW给药的MSI-H/dMMR适应症关键临床试验中,总体人群经确认ORR为42.7%,其中结直肠癌患者ORR为43.1%,胃癌患者ORR为44.4%。而在采用5.0 mg/kgQ2W给药的上述晚期胃癌或胃食管交界处癌Ⅱ期研究中,研究者评估的确认ORR为60%,未确认ORR为73.3%。“原来担心恩沃利单抗分子量较小,代谢速度会比较快,所以选择150mgQW给药。但随着数据积累,我们发现血药浓度5μg/mL是该药物的有效浓度,只要超过这一浓度,药物的抗肿瘤作用是相似的。临床研究也证实延长给药间隔,采用300mgQ2W用药方案,对于治疗的安全性和有效性没有影响。”肖申说,“因为提供了充分的证据,新增300mgQ2W给药的批准过程是比较顺利的。”总体来看,恩沃利单抗新增给药方案的过程,与FDA 肿瘤疾病办公室医学肿瘤学家 Mirat Shah此前在介绍Optimus项目时提到的方法类似:首先,对非临床数据、PK/PD 数据以及早期疗效和安全性数据,进行充分收集和探索,作为剂量选择的基础信息;其次,研究确定暴露/反应关系,及其与有效性和安全性之间的关系。最后,在初始剂量递增后进行多剂量扩展队列研究,获得更多不同剂量组的疗效和安全性信息,从而做出最佳选择。
出海+联用+新用药方案稳固市场优势
据思路迪医药招股书所述,除上述提到的五项已完成临床试验外,恩沃利单抗还有七项临床试验正在进行,另有三项研究正在启动。因此,未来产品可能有更多适应症及新给药方案,在中国或美国获批。恩沃利单抗目前有数项临床研究在美国进行。2019年底,思路迪医药、康宁杰瑞与TRACON达成三方合作协议,由TRACON负责美国为主北美市场恩沃利单抗治疗软组织肉瘤的临床开发和商业化工作。目前TRACON已发起针对选定类型晚期肉瘤(SC)的Ⅱ期临床试验,FDA于2021年6月28日授予恩沃利单抗治疗软组织肉瘤孤儿药和快速研发通道资格认定。另外,该产品亦计划在美国开展针对dMMR晚期癌症患者的关键临床研究。“恩沃利单抗在海外市场的目标是开发差异化适应症。首先针对不能接受静脉给药的患者,国外尚未有PD-1/L1抑制剂皮下注射剂型获批。此外,目前美国尚未有PD-1/L1抑制剂获批软组织肉瘤适应症,针对MSI-H/dMMR晚期癌症也仅两个产品获得有条件批准。”肖申说,“如果临床试验成功,恩沃利单抗最早可能在2024年底到2025年底间,在美国获批上市。”国内研究方面,现有一项针对晚期胆道癌(BTC)的Ⅲ期临床试验正在进行,已于2018年4月入组首例患者。该研究计划入组约480名患者,截至2022年7月18日,已有472名受试者被纳入研究。FDA于2020年1月16日,也授予恩沃利单抗治疗晚期BTC孤儿药资格认定。此外,该产品还在中国开展针对高肿瘤突变负荷(TMB-H)晚期实体瘤的Ⅱ期临床试验,目前也有数十名患者已经入组。除了单药研究外,肖申透露恩沃利单抗已有多项联合用药研究计划,部分联用研究已经启动。思路迪医药现有两款引进产品——GAS6/AXL抑制剂3D229及多肽肿瘤疫苗3D189肿瘤疫苗3D189,进入临床后期开发阶段。去年7月6日,国家药审中心批准3D229加入全球国际多中心Ⅲ期临床试验;3D189国外的Ⅲ期多中心临床研究正在开展,国内IND申请也于今年初获批。“预计未来两年这两个产品的单药Ⅲ期研究就能完成,届时可以进一步开展GAS6/AXL抑制剂或肿瘤疫苗与PD-L1单抗的联用研究,此有望将恩沃利单抗的适应症拓展到肺癌等大瘤种。”肖申说。此外,恩沃利单抗与先声药业的赛伐珠单抗联用,在中国已完成卵巢癌治疗Ⅰ期临床,目前正在开展进一步有效性的研究。这些研究将大大增加恩沃利单抗的应用范围。 上述研究,也将为恩沃利单抗进一步延长给药间隔至三周或者四周一次,提供安全和有效性数据的积累。预计还需要等待一年到一年半时间。肖申说,思路迪医药在临床研究设计中,还会考虑不同国家患者的差异。 “亚洲人体重比欧美人更轻,所以不同国家单次给药剂量选择是不同的,可能中国、日本患者接受的都是300mgQ2W,但美国患者采用600mgQ3W。”肖申说,“等数据积累到一定程度,把不同给药剂量及间隔病人的血药浓度变化合并分析,并结合安全性及有效性数据,就能推导出3周或4周一次给药的最佳剂量,中国、美国、日本我们会分别计算。”“每项研究的每个患者我们都会进行PK/PD数据检测。”根据肖申所述,为患者探索最佳给药方案,恩沃利单抗始终在进行。
内容来源于网络,如有侵权,请联系删除。
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



