设计CD117/LNP递送改造血干细胞治疗非恶性造血疾病
基因疗法信使RNA疫苗
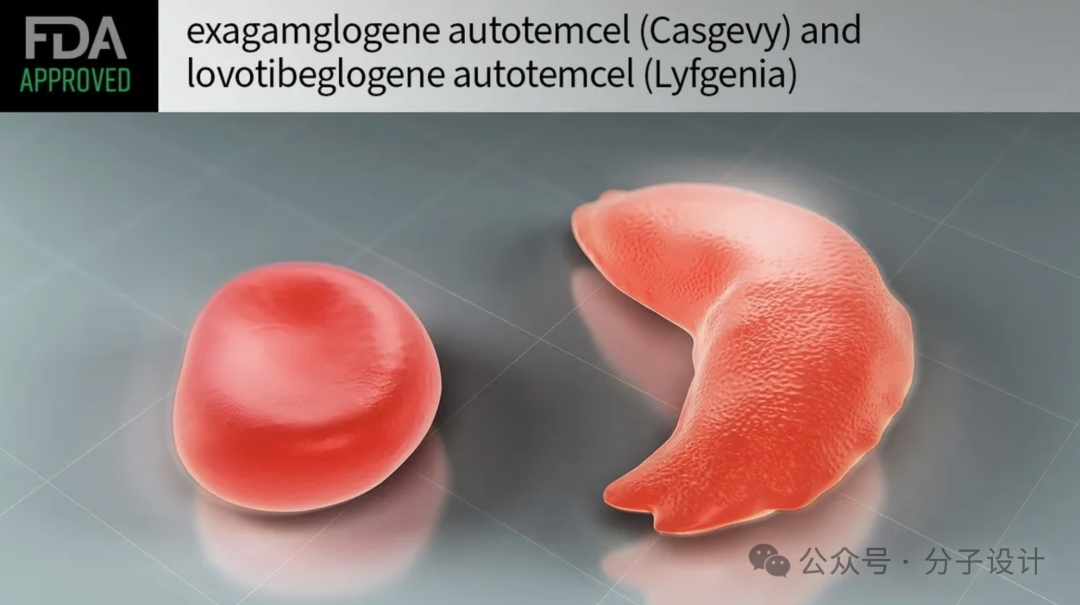
镰状细胞病 (Sickle cell disease, SCD)是血红蛋白病之一,是一组典型的遗传性血液疾病。镰状细胞病是血红蛋白(红细胞中的携氧蛋白)的基因异常。在镰状细胞病中,红细胞中的携氧蛋白(血红蛋白)受到损害。健康的血红蛋白由两条α链和两条β链组成;患者携带 β-珠蛋白基因点突变,导致β-珠蛋白链第6位谷氨酸被缬氨酸取代。这种变化导致当氧未结合时形成刚性聚合物的结构,导致红细胞呈现刚性的镰刀或新月形状。
Preview
来源: 生物制品圈
2023年FDA批准了两种 SCD 基因疗法,慢病毒基因疗法 Lovotibeglogene autotemcel (Lyfgenia) 和利用CRISPR/Cas9 基因编辑的Exagamglogene autotemcel( Casgevy )疗法。Lyfgenia (利芙吉尼亚)是以Lyfgenia (蓝鸟生物基因治疗公司 )开发,先收集受者自身的干细胞,然后受者必须接受清髓性调理(高剂量化疗),修饰细胞替换自身的干细胞。Casgevy(卡斯格维)由Vertex Pharmaceuticals和CRISPR Therapeutics开发,通过cas9编辑BCL11A降低其活性,使细胞产生胎儿血红蛋白。受者必须接受清髓性调理(高-剂量化疗),修饰的血液干细胞被移植回受体体内,并在骨髓中植入(附着和繁殖),并增加胎儿血红蛋白 (HbF) 的产生,胎儿血红蛋白是一种促进氧气输送的血红蛋白。
然而,目前的疗法的局限性在于:(1)无法避免移植物抗宿主病(Graft versus host disease ,GVHD);(2)需要清髓性调理(高剂量化疗);(3)需要体外改造和回输造血干细胞。为了克服上述困难,来自宾州儿童医院的研究团队开发了通过mRNA直接对宿主造血干细胞进行改造的方法和靶向性更高的清髓性调理的方法。
Preview
来源: 生物制品圈
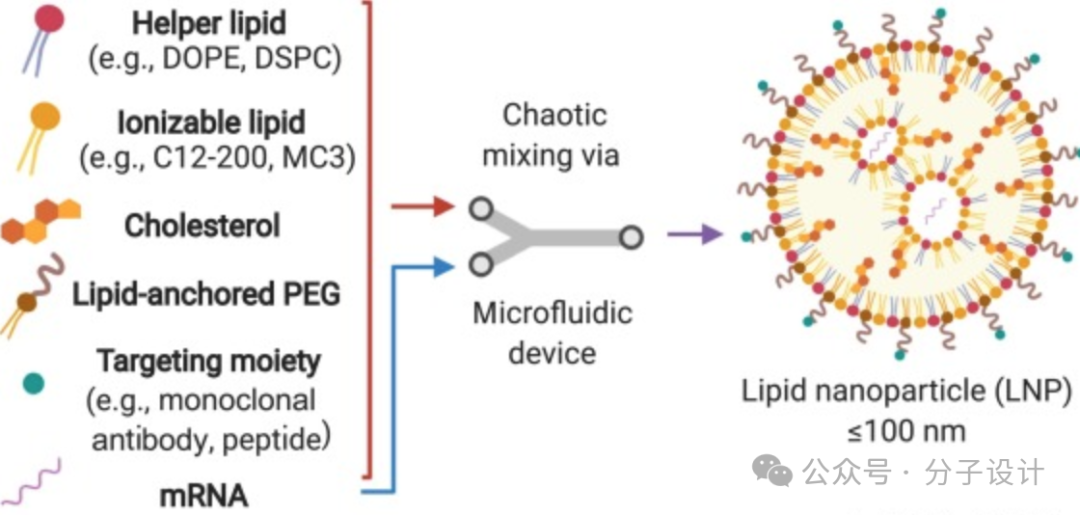
首先,为靶向造血干细胞进行输送有效的基因,需要对应有效的高效载体。造血干细胞(Hematopoietic Stem Cell, HSC)依赖于基质衍生因子,包括干细胞因子(SCF),其与受体c-Kit(CD117)结合。CD117在短期和长期HSC和一些造血祖细胞上均有表达。CD117在SCF结合后内化,研究假设这可能促进或增强LNP内化。核苷修饰和纯化的mRNA是非免疫原性的、稳定的和可扩展的,可用于表达几乎任何感兴趣的蛋白质。脂质体纳米颗粒(lipid nanoparticle, LNP)是迄今为止最有希望的递送系统,以实现mRNA的治疗潜力。这些LNP含有可电离的脂质(在pH<6.4带正电荷),有助于包装mRNA和内体逃逸。这种LNP于2018年首次被批准用于小干扰RNA,由于莫德纳和辉瑞COVID-19疫苗的LNP-mRNA平台,这种LNP在2020年被广泛使用。
Preview
来源: 生物制品圈
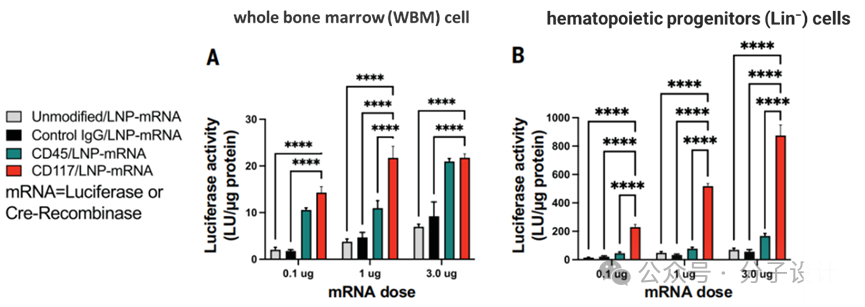
研究人员首先通过比较在WBM,LIN-细胞亚群中荧光的表达情况,验证CD117相对于CD45可以更有效的实现mRNA靶向递送。
Preview
来源: 生物制品圈
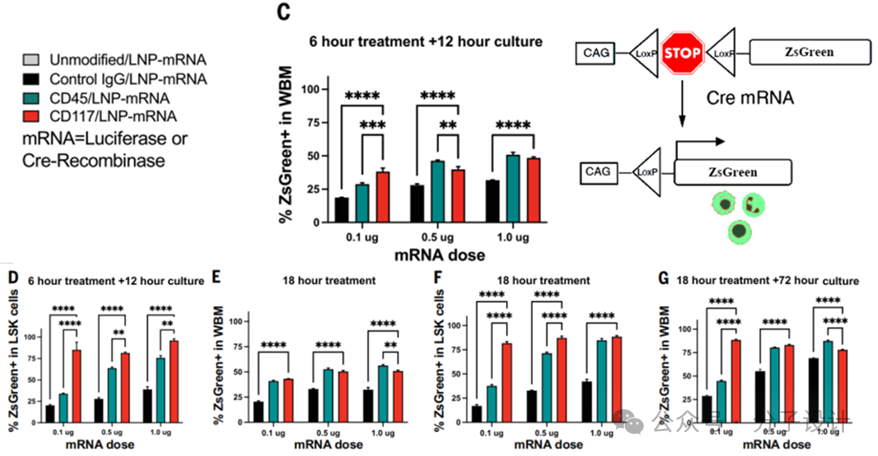
再通过探究不同的时间点的CD117/LNP-mRNA体外编辑效果,发现编辑的发生主要集中在18h,证明了编辑的发生存在一定的剂量依赖性,并且 CD117/LNP-Cre编辑效率大于CD45/LNP-Cre。
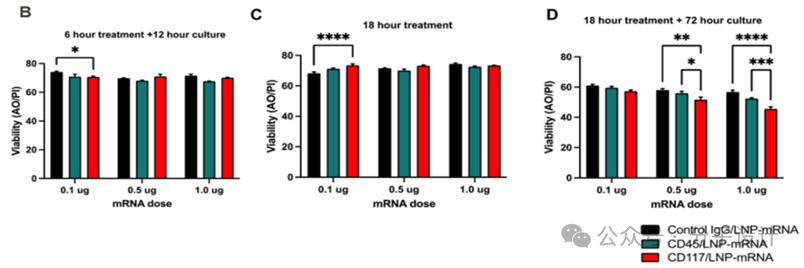
Preview
来源: 生物制品圈
并初步证明所构建载体无明显细胞毒性,明确了CD117/LNP-mRNA 体外编辑的安全性。
Preview
来源: 生物制品圈
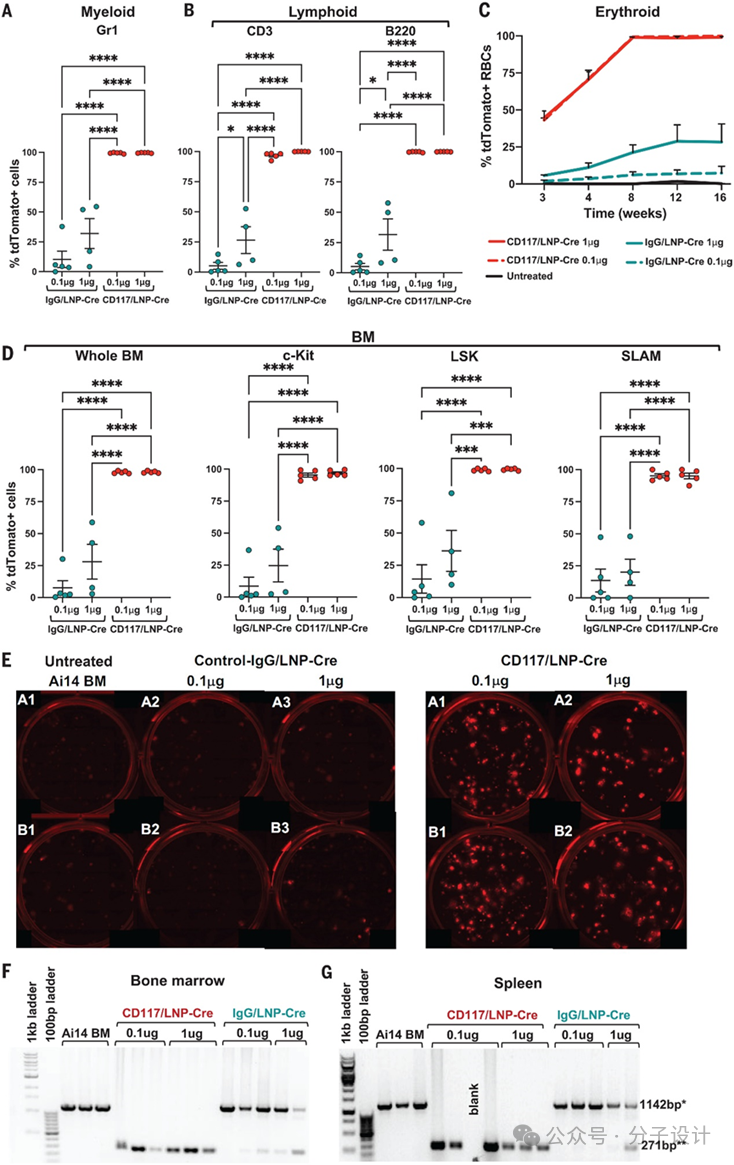
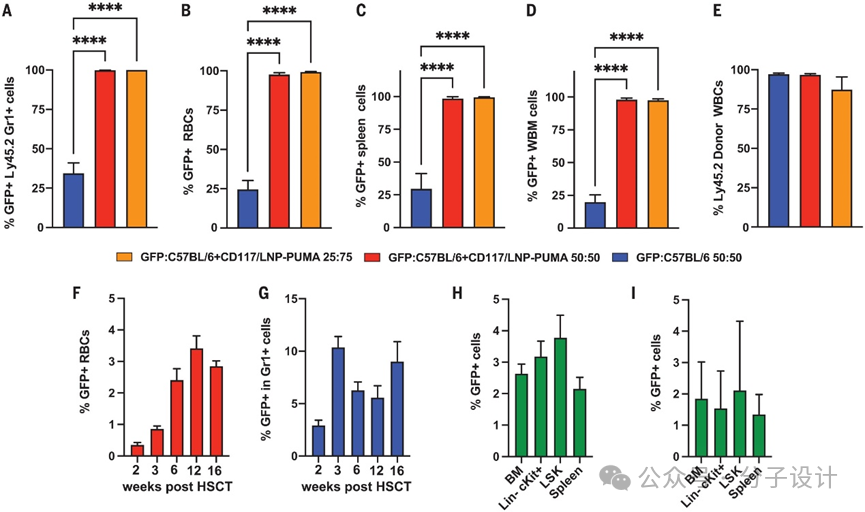
进一步,使用经致死辐射的同源 C57BL/6 CD45.1 受体小鼠创建骨髓移植 (BMT) 模型。经过HSCT处理后,四月后髓内长期造血干细胞以及外周髓系(Gr1+),淋系(CD3+ ,B220+),红细胞都得到了有效的编辑(图4A-E)。分离的造血祖细胞集落形成实验(CFU assay) 进一步佐证了之前体内的数据,呈现td Tomato的红色荧光(tdTomato 是一种非常明亮的红色荧光蛋白,比 EGFP 亮 6 倍。tdTomato 的发射波长 (581 nm) 和亮度使其成为活体动物成像研究的理想选择)。半定量PCR下移植四个月后的骨髓和脾脏内细胞的编辑效果一致,验证了CD117/LNP-mRNA体外对HSC编辑的效能。
Preview
来源: 生物制品圈
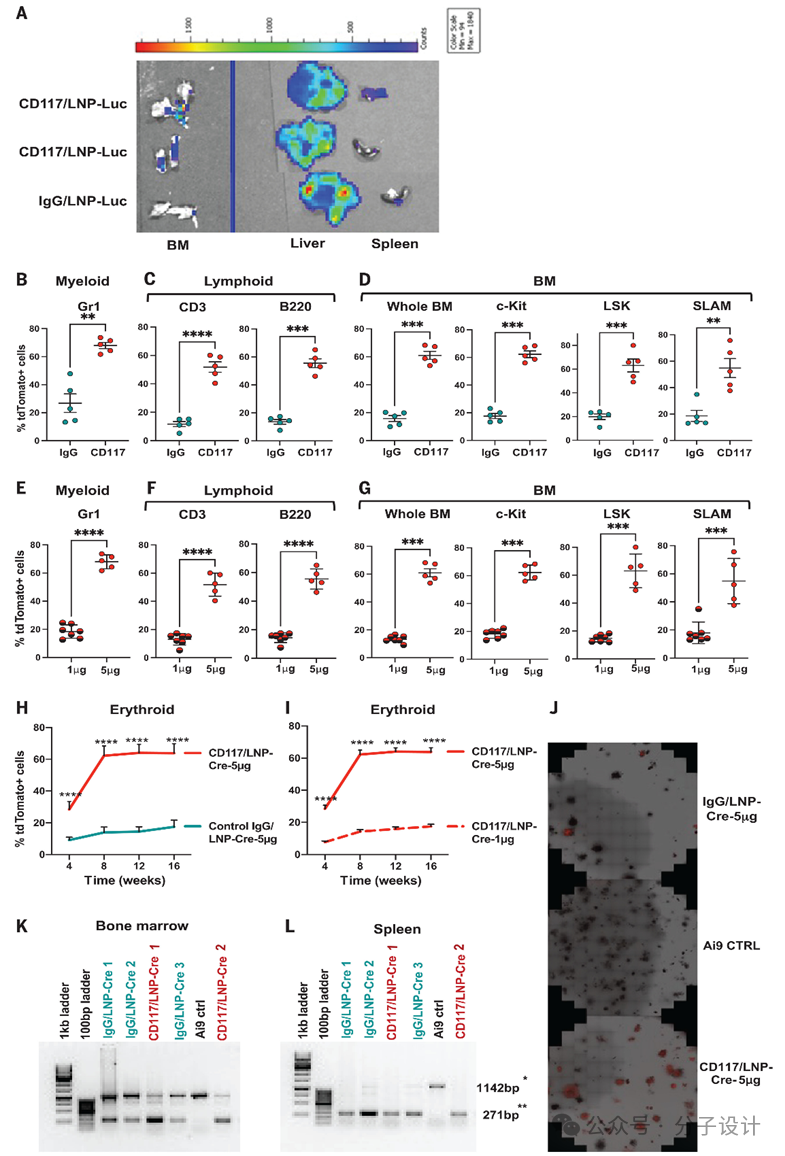
通过在小鼠体内注射CD117/LNP-Luc后,BM荧光检测阳性,说明CD117/LNP-Luc可以起到对于BM的靶向作并起到有效的基因编辑效果。并且体内细胞编辑的水平与给与的CD117/LNP-mRNA存在浓度依赖性。利用CFU以及半定量PCR进一步验证了CD117/LNP-mRNA对HSC的编辑,并明确CD117/LNP-Cre制剂在体内注射后在 LT-HSC 中产生 >50% 的 tdTomato 标记。
Preview
来源: 生物制品圈
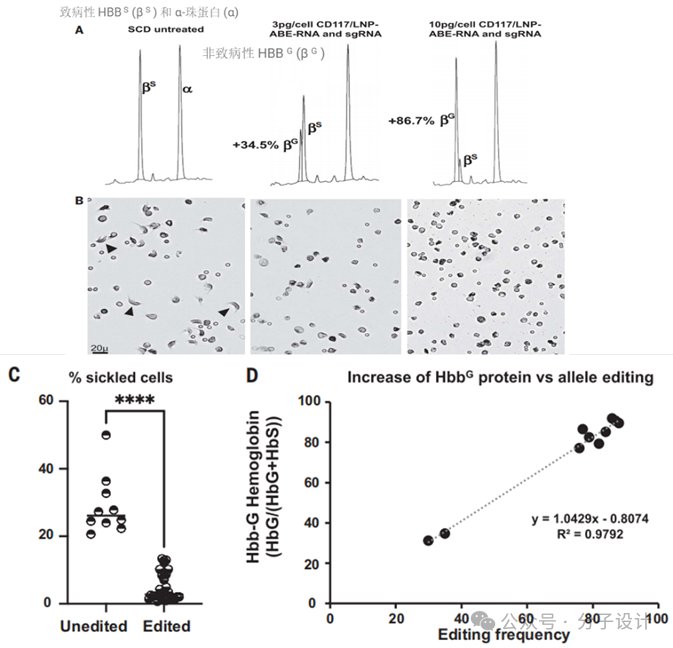
进一步,对比含有mRNA和编码Cas9腺嘌呤碱基编辑器(ABE)融合的LNPs和携带针对β -珠蛋白镰状细胞突变的导向RNA (sgRNA)的LNPs,CD117/LNP-ABE-RNA 和 sgRNA体外可以有效编辑镰刀形态红细胞实现治疗(GAG-GCG),且转变水平与给药剂量呈现正相关。
Preview
来源: 生物制品圈
理论上mRNA改造造血干细胞中不需要进行清髓性调理(高剂量化疗),但临床中常常还需要用到,还需补充开发清髓性调理的新方法。因此,完成CD117/LNP-ABE对 E6V 镰状细胞突变进行碱基编辑后,研究人员补充了一个新的消耗消耗造血干细胞HSC的方法。
综上,该研究使用mRNA输送碱基编辑器直接在患者体内进行了SCD的治疗,巧妙地利用了CD117作为靶向进行更高效的编辑,一次性治疗可将SCD患者的β珠蛋白恢复到健康机体的80%以上。但目前的治疗依旧存在非特异的编辑,而且缺乏被编辑鼠长期存活的数据。解决安全性问题和靶向问题依旧是基因治疗在体内应用的重要难点。这些工作在未来的研究中仍亟待解决。
参考文献
Laura Breda, Tyler E Papp, Michael P Triebwasser, Amir Yadegari, Megan T Fedorky, Naoto Tanaka, Osheiza Abdulmalik, Giulia Pavani, Yongping Wang, Stephan A Grupp, Stella T Chou, Houping Ni, Barbara L Mui, Ying K Tam, Drew Weissman, Stefano Rivella, Hamideh Parhiz. In vivo hematopoietic stem cell modification by mRNA delivery. Science. 2023, 381(6656): 436-443.
内容来源于网络,如有侵权,请联系删除。
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。





