大冢制药APRIL单抗Sibeprenlimab 3期临床结果积极,治疗IgA肾病
10月23日,大冢制药宣布其在研单抗sibeprenlimab用于治疗免疫球蛋白A(IgA)肾病成人患者3期临床试验VISIONARY的积极中期数据。分析显示,试验达成主要终点。大冢计划与FDA讨论试验的中期结果,以推动sibeprenlimab潜在加速批准的监管申请。该研究仍在进行中,最终结果预计将在2026年初公布。
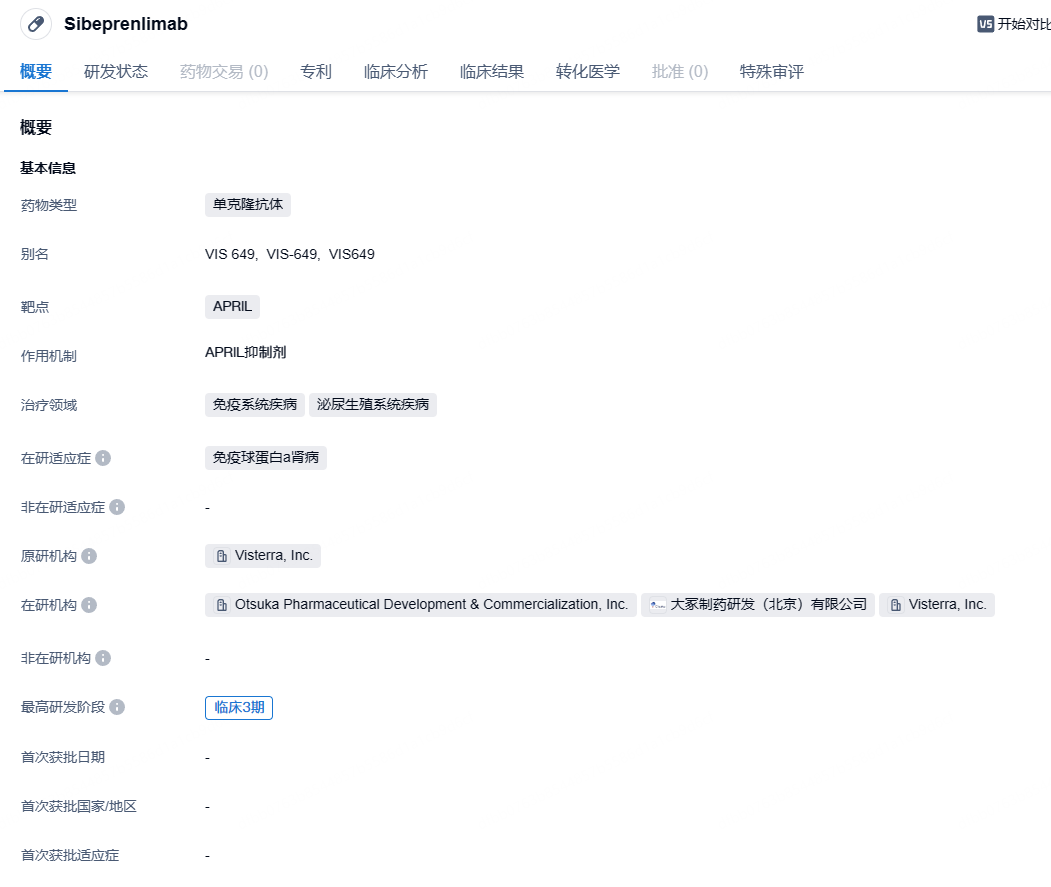
Sibeprenlimab是一种在研人源化单克隆抗体,它能阻断细胞因子A增殖诱导配体(APRIL)的作用,曾获美国FDA突破性疗法认定。2018年大冢制药宣布以约4.3亿美元的款项收购Visterra公司,从而获得包括sibeprenlimab在内一系列针对IgA肾病和其他肾脏疾病等适应症的在研产品。
VISIONARY研究共纳入约530名接受标准治疗的IgA肾病成年患者,旨在评估与安慰剂相比,每四周皮下给药一次400 mg sibeprenlimab的疗效和安全性。主要疗效终点为评估治疗9个月时24小时尿蛋白/肌酐比值(uPCR)相较于基线的变化。结果表明,与安慰剂相比,sibeprenlimab在治疗9个月后显著且具有临床意义地降低了24小时尿蛋白/肌酐比值。
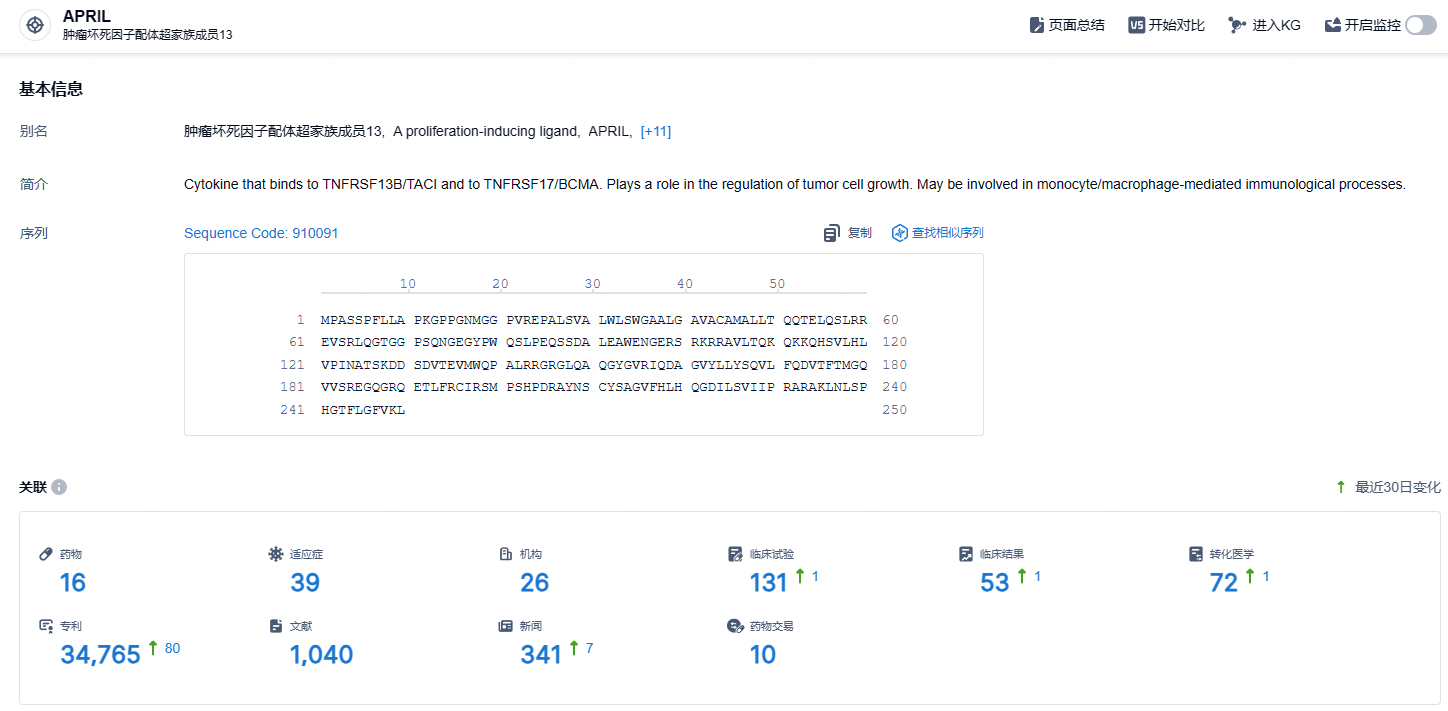
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 APRIL靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月24日,APRIL靶点共有在研药物16个,包含的适应症有39种,在研机构26家,涉及相关的临床试验131件,专利多达34765件……根据弗若斯特沙利文报告,全球IgAN患者人数由2016年的887.64万人增加至2020年的926.69万人(包括中国的220万人)。预计全球IgAN患者总数将于2025年达到973.06万人(包括中国230万人),并于2030年达到1,016.52万人(包括中国237万人)。在整个疾病过程中,多达50%的患者需要进行透析或肾脏移植。期待Sibeprenlimab能够早日获批,能够为患者带来新的治疗选择。