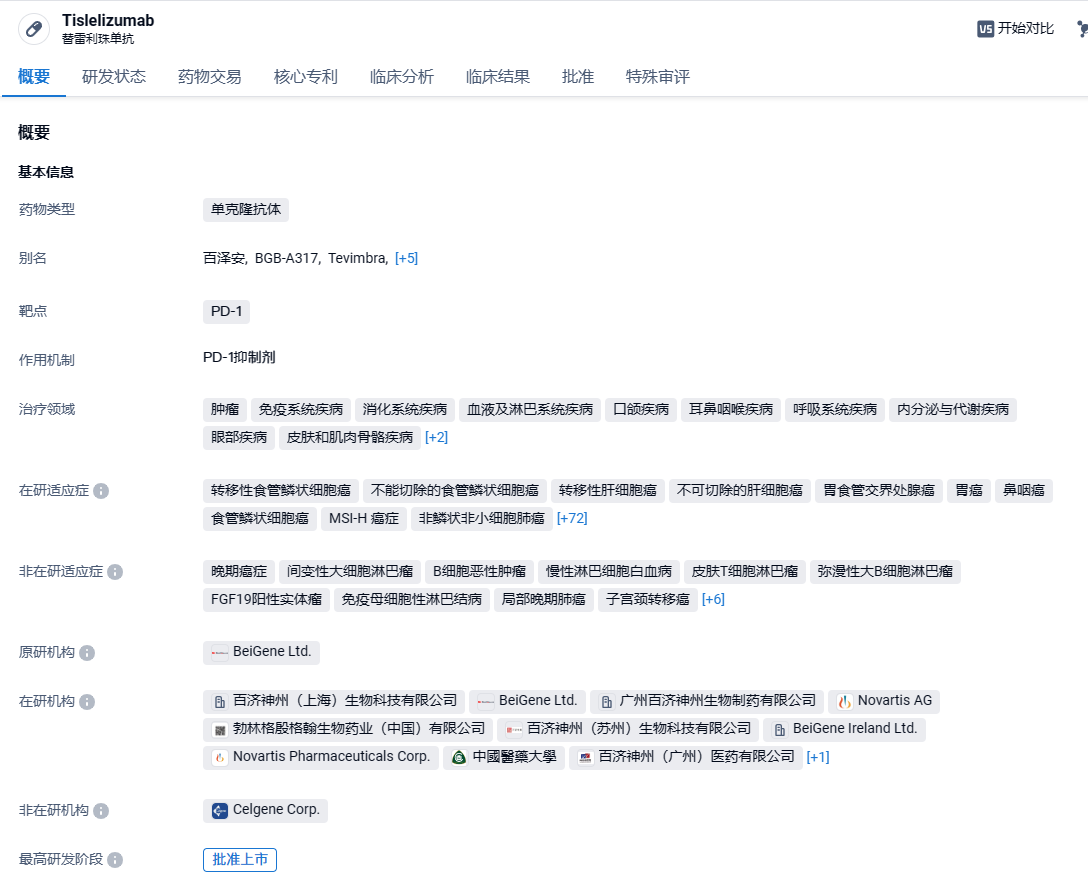
百济神州PD-1单抗替雷利珠单抗在中国获批第14项适应症,针对非小细胞肺癌
10月21日,百济神州宣布,其PD-1抑制剂百泽安®(替雷利珠单抗)正式获得中国国家药品监督管理局批准,联合含铂化疗新辅助治疗,并在手术后继续本品单药辅助治疗,用于可切除的II期或IIIA期非小细胞肺癌患者的治疗。
百泽安®(替雷利珠单抗注射液)是一款人源化IgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了PD-1抗体的抗肿瘤活性。百泽安®是第一款由百济神州的免疫肿瘤生物平台研发的药物,目前正进行单药及联合疗法临床试验,以开发一系列针对实体瘤和血液肿瘤的广泛适应症。2021年1月,百济神州曾与诺华就PD-1抗体替雷利珠单抗达成首付款6.5亿美元,总价超22亿美元的合作,百济神州瑞士授予诺华在美国、加拿大、墨西哥、欧盟成员国、英国、挪威、瑞士、冰岛、列支敦士登、俄罗斯和日本开发、生产和商业化替雷利珠单抗的权利。根据授权协议,诺华负责在授权国家的注册申请,并有权在获批后开展商业化活动。2023年9月19日晚间,百济神州宣布其自主研发抗PD-1抗体替雷利珠单抗(百泽安®)获得欧盟批准,作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。同日,百济神州宣布,已与诺华签订了终止合作协议,即诺华退还PD-1药物替雷利珠单抗在美国、欧盟成员国等国家/地区的全球化开发、生产和商业化权益。2024年2月27日,百济神州宣布,美国食品和药物管理局(FDA)已经受理了替雷利珠单抗的生物制品许可申请(BLA),与含氟嘧啶和铂化疗联合治疗局部晚期不可切除或转移性胃或胃食管交界处(G/GEJ)腺癌患者。FDA预计将于2024 年12 月对该BLA作出决定。
本次获批是基于RATIONALE 315(NCT04379635)的临床试验数据。研究结果显示,与围术期安慰剂联合新辅助化疗相比,围术期替雷利珠单抗联合新辅助化疗显著提高了MPR率(56.2% vs 15.0%)和病理学完全缓解率(pCR率,40.7% vs 5.7%),并显著延长了EFS(HR:0.56,95% CI: 0.40~0.79),且已观察到总生存期(OS)显示良好的延长趋势(HR:0.62,95% CI: 0.39~0.98);该治疗方案的总体耐受性良好,未发现新的安全性信号。此项研究的结果也已在2024年2月召开的欧洲肿瘤内科学会年会全体会议(ESMO plenary session)上发布。
2024年3月15日,百济神州(BeiGene)宣布,美国FDA已批准其食管鳞状细胞癌PD-1抑制剂Tevimbra(tislelizumab,替雷利珠单抗)作为单药疗法,用于治疗既往接受过全身化疗,针对(不包括PD-1或PD-L1类疗法),患有不可切除或转移性食管鳞状细胞癌(ESCC)的成年患者。
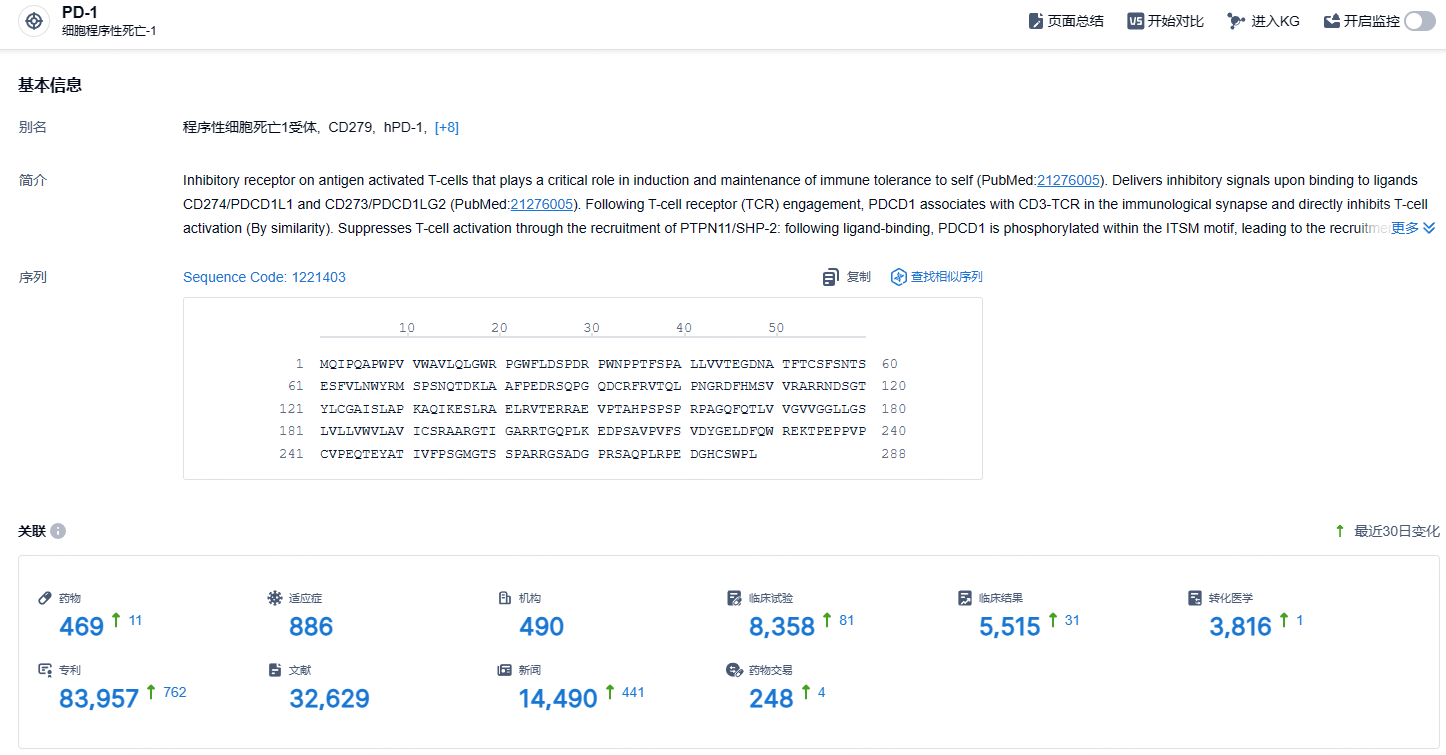
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月22日,PD-1 靶点共有在研药物469个,包含的适应症有886种,在研机构490家,涉及相关的临床试验8358件,专利多达83957件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有16款相关新药上市,替雷利珠单抗2023年在国内销售额高达38亿元。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重。作为首款在欧美均成功获批的国产PD-1单抗,替雷利珠单抗的商业化设计和临床设计非常值得国内PD-1/PD-L1新药企业的学习。期待有更多国产新药登陆欧美发达国家的医药市场。