FDA推迟批准安进KRAS抑制剂sotorasib结直肠癌适应症
10月18日,据外媒FirstWord报道,美国FDA已将安进KRAS G12C抑制剂Lumakras(sotorasib)联合抗EGFR单抗panitumumab二线治疗KRAS G12C突变的转移性结直肠癌(CRC)适应症的审查时间延长了三个月,推迟到明年1月17日再做出审批决定。
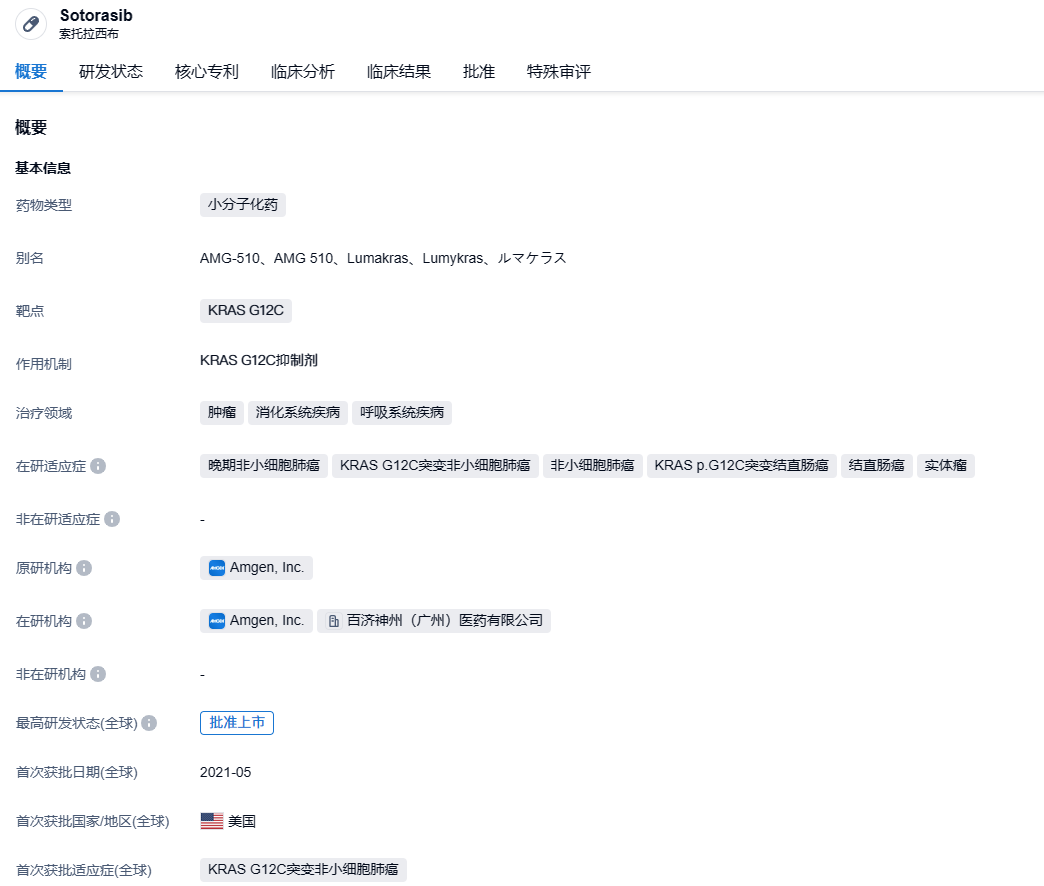
sotorasib是Carmot Therapeutics和安进合作开发的一款KRAS G12C抑制剂,百济神州获得其在中国的独家商业化权利。sotorasib(AMG-510)于2021年5月获得美国食品药品监督管理局(FDA)批准上市,适用于治疗既往接受过至少1种全身治疗的KRAS G12C突变型局部晚期或转移性非小细胞肺癌(NSCLC)成人患者(通过FDA批准的检测方法确定)。这是全球首个靶向KRAS突变的抗肿瘤药物。
该申请得到了III期CodeBreaK 300研究(NCT05198934)的数据支持。ASCO 2024大会上公布的CodeBreaK 300研究总生存期(OS)数据显示,与研究者选择的曲氟尿苷/替匹嘧啶或瑞戈非尼相比,接受 sotorasib+panitumumab治疗的mCRC患者OS有改善的趋势,中位OS未达到,而研究者选择的疗法的中位OS为10.3个月,风险比为0.70。
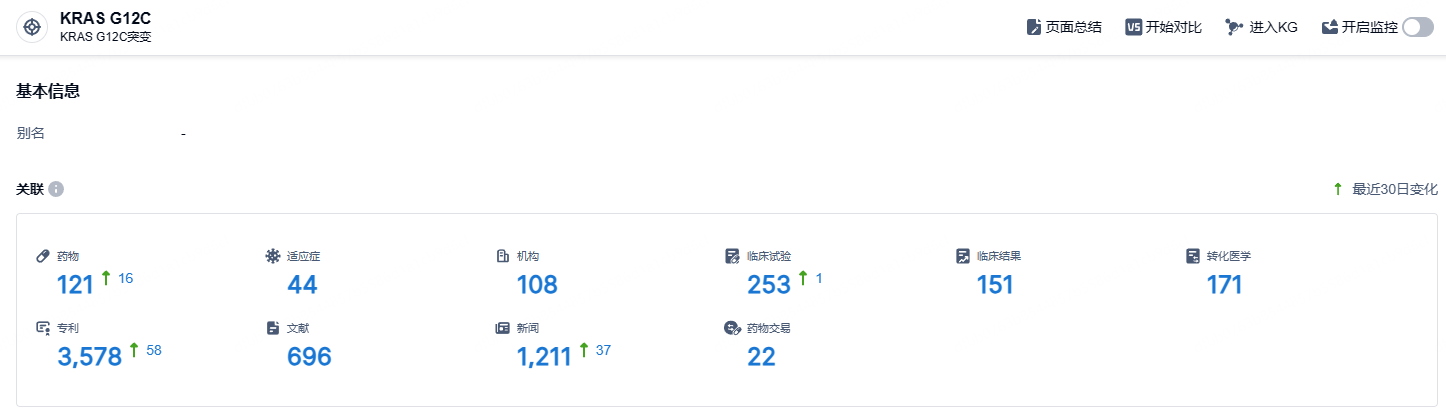
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 KRAS G12C 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年10月19日,KRAS G12C靶点共有在研药物121个,包含的适应症有44种,在研机构108家,涉及相关的临床试验253件,专利多达3578件……目前FDA已经批准了两款KRAS G12C抑制剂,国内外还有大量处于临床阶段的KRAS G12C抑制剂。KRAS G12C,曾经被认为是“不可成药”,现在已经成为“可成药”最热门的靶标之一。