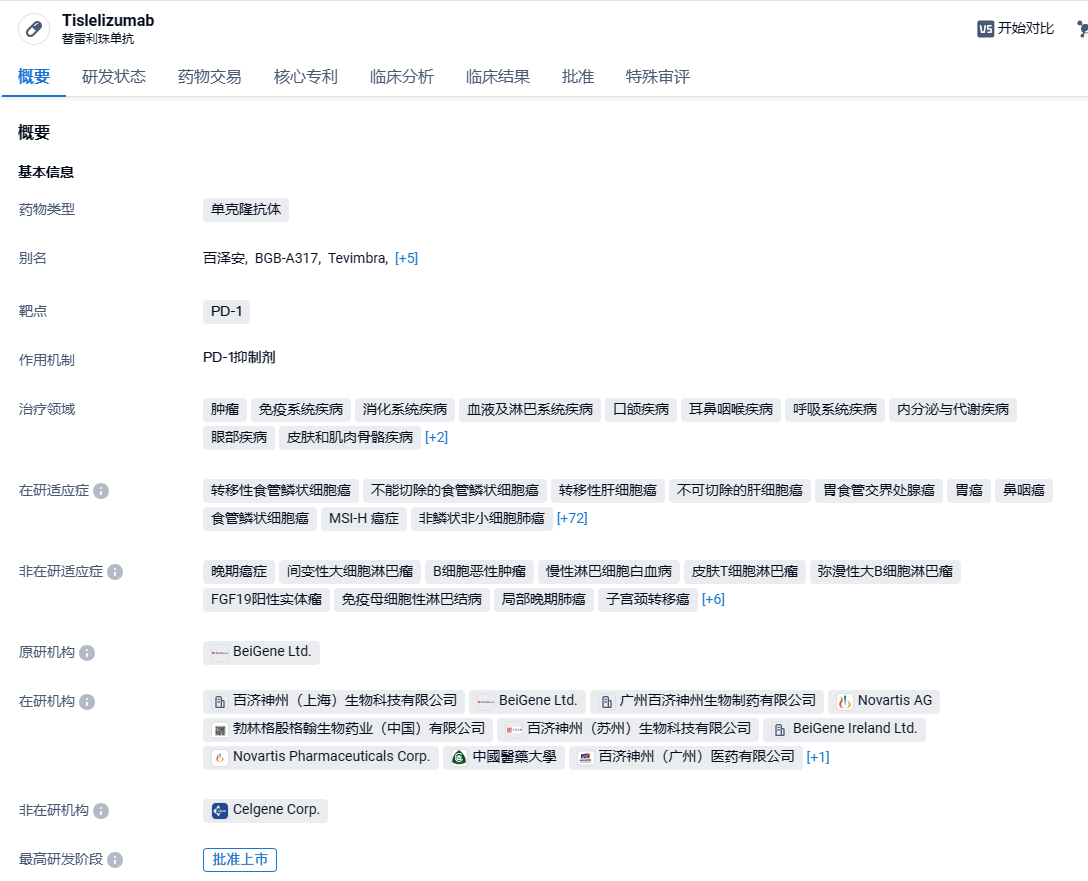
百济神州PD-1抑制剂替雷利珠单抗获欧洲CHMP积极意见,一线治疗胃癌和食管癌
10月22日,百济神州宣布欧洲药品管理局(EMA)人用药品委员会(CHMP)发布积极意见,推荐批准扩大PD-1抑制剂百泽安®(替雷利珠单抗)用于胃或胃食管结合部(G/GEJ)腺癌和食管鳞状细胞癌(ESCC)患者治疗的适应症,以拓展至一线疗法。
百泽安®(替雷利珠单抗注射液)是一款人源化IgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了PD-1抗体的抗肿瘤活性。百泽安®是第一款由百济神州的免疫肿瘤生物平台研发的药物,目前正进行单药及联合疗法临床试验,以开发一系列针对实体瘤和血液肿瘤的广泛适应症。2021年1月,百济神州曾与诺华就PD-1抗体替雷利珠单抗达成首付款6.5亿美元,总价超22亿美元的合作,百济神州瑞士授予诺华在美国、加拿大、墨西哥、欧盟成员国、英国、挪威、瑞士、冰岛、列支敦士登、俄罗斯和日本开发、生产和商业化替雷利珠单抗的权利。根据授权协议,诺华负责在授权国家的注册申请,并有权在获批后开展商业化活动。2023年9月19日晚间,百济神州宣布其自主研发抗PD-1抗体替雷利珠单抗(百泽安®)获得欧盟批准,作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。2024年3月15日,百济神州宣布,FDA 已批准替雷利珠单抗上市,用于治疗既往经系统化疗后不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)成年患者。
一线G/GEJ适应症扩展申请基于百济神州RATIONALE-305(NCT03777657)研究结果,数据显示,接受百泽安®联合研究者选择的化疗的患者中位OS为15.0个月,而安慰剂联合化疗为12.9个月(n=997),表明死亡风险降低了20%;在PD-L1≥5%的人群中,相应数据为16.4个月vs. 12.8个月,表明死亡风险降低了29%。一线ESCC适应症扩展申请基于百济神州RATIONALE-306(NCT03783442)研究结果。在意向性治疗人群中,百泽安®联合化疗组中位OS为17.2个月,而安慰剂组10.6个月,表明死亡风险降低了34%;PD-L1≥5%的患者群体中,相应数据为19.1个月vs. 10.0个月,表明死亡风险降低了38%。
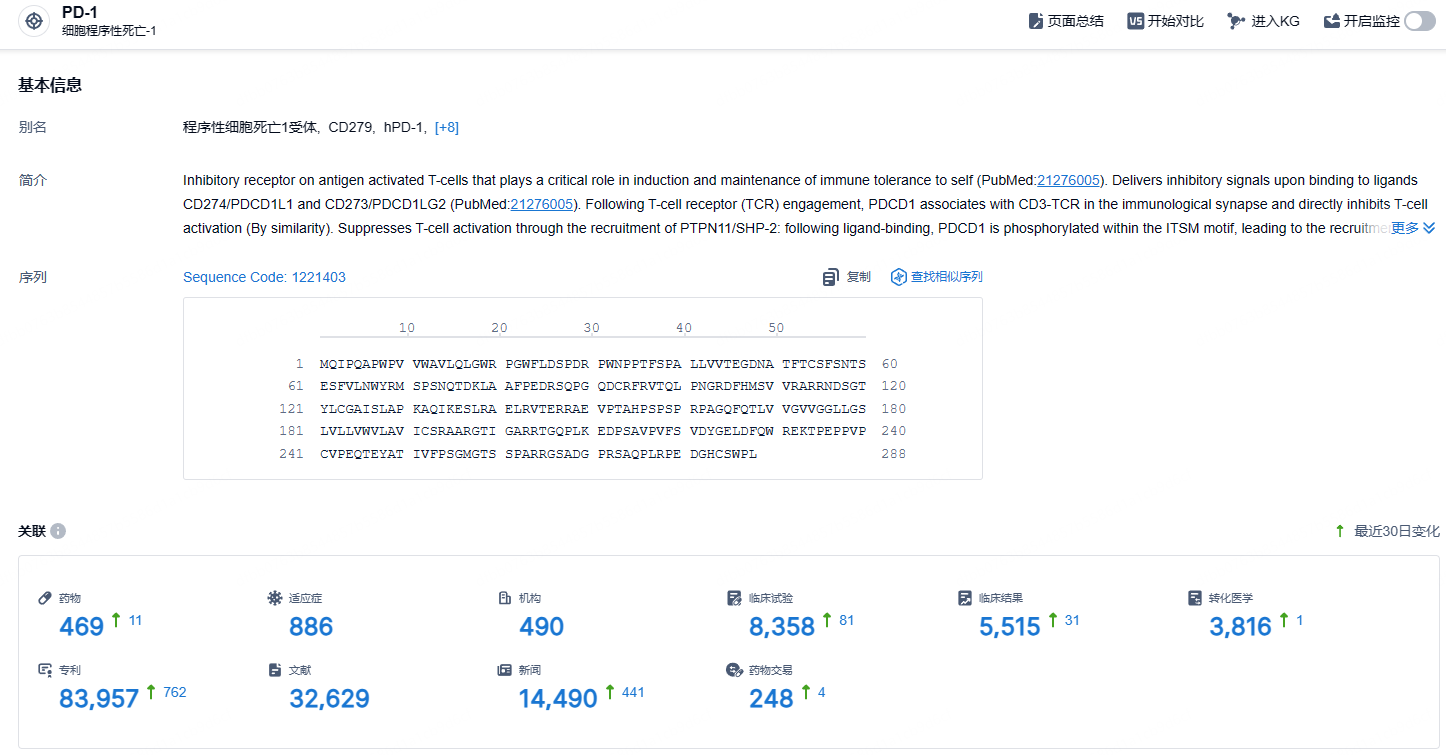
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月23日,PD-1 靶点共有在研药物469个,包含的适应症有886种,在研机构490家,涉及相关的临床试验8358件,专利多达83957件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有16款相关新药上市,替雷利珠单抗2023年在国内销售额高达38亿元。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重。作为首款在欧美均成功获批的国产PD-1单抗,替雷利珠单抗的商业化设计和临床设计非常值得国内PD-1/PD-L1新药企业的学习。期待有更多国产新药登陆欧美发达国家的医药市场。