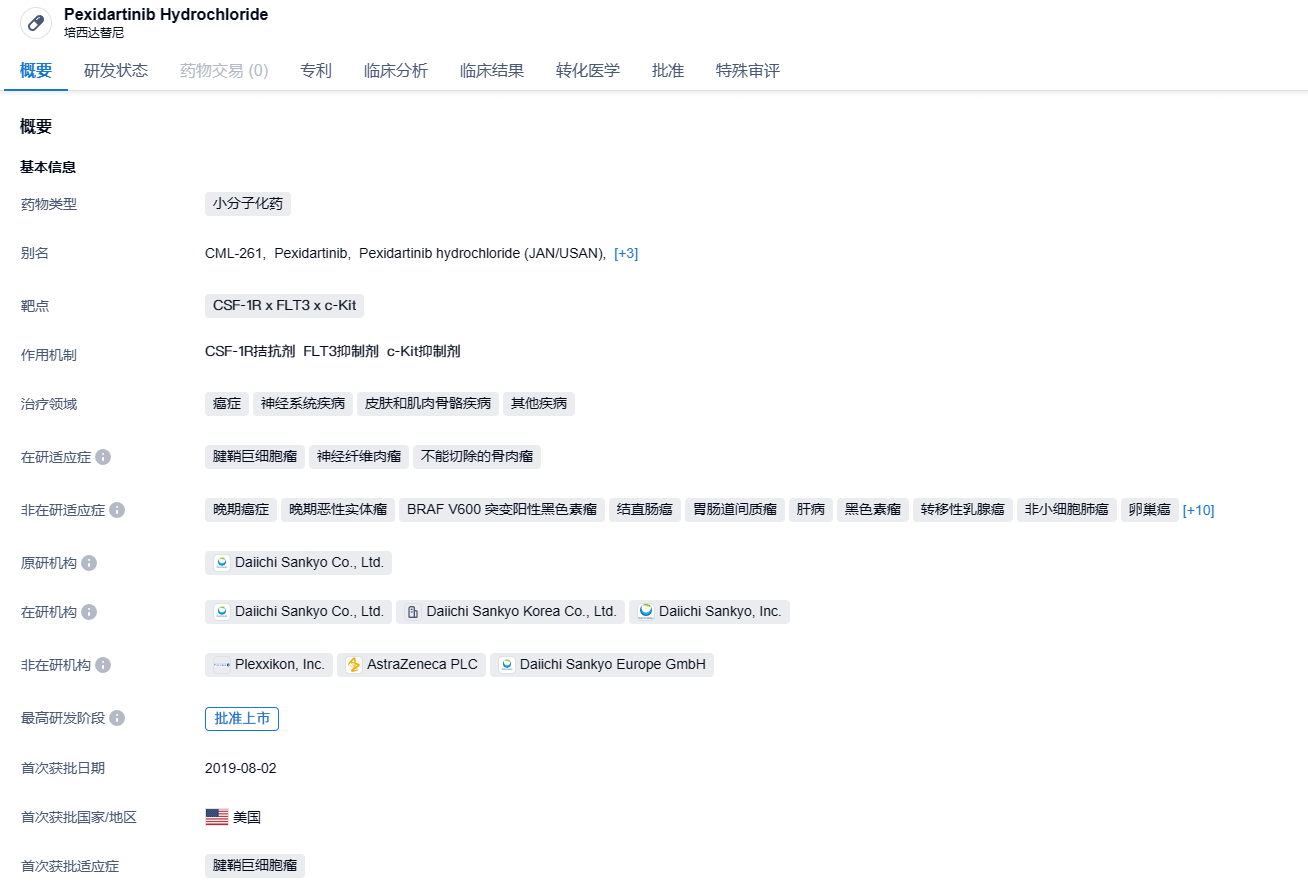
第一三共口服CSF1R小分子抑制剂抗肿瘤新药吡昔替尼在中国拟纳入优先审评
10月24日,CDE官网公示,第一三共申报的盐酸吡昔替尼胶囊(PLX3397)拟纳入优先审评,适用于治疗伴有重度病变或功能受限且无法通过手术改善的症状性腱鞘巨细胞瘤(TGCT)成年患者。
吡昔替尼(pexidartinib)是一款CSF1R小分子抑制剂,同时也会抑制c-kit和FLT3-ITD的活性。此前曾被FDA授予突破性疗法认定、孤儿药资格和优先审评资格,并已于2019年8月获得美国FDA批准上市,治疗症状性腱鞘巨细胞瘤成人患者。根据FDA彼时的新闻稿介绍,这是其批准的首个治疗TGCT的治疗方法。
该药在 FDA 获批是基于一项关键 III 期 ENLIVEN 研究的积极数据。ENLIVEN 研究入组了 120 例患者,1:1 随机分配至 Pexidartinib 组(61 例)和安慰剂组( 59 例),主要疗效终点是治疗 25 周后总缓解率(ORR)。数据显示,治疗第 25 周,口服 Pexidartinib 治疗组 ORR 为 39%,安慰剂组为 0%,达到了研究的主要终点。
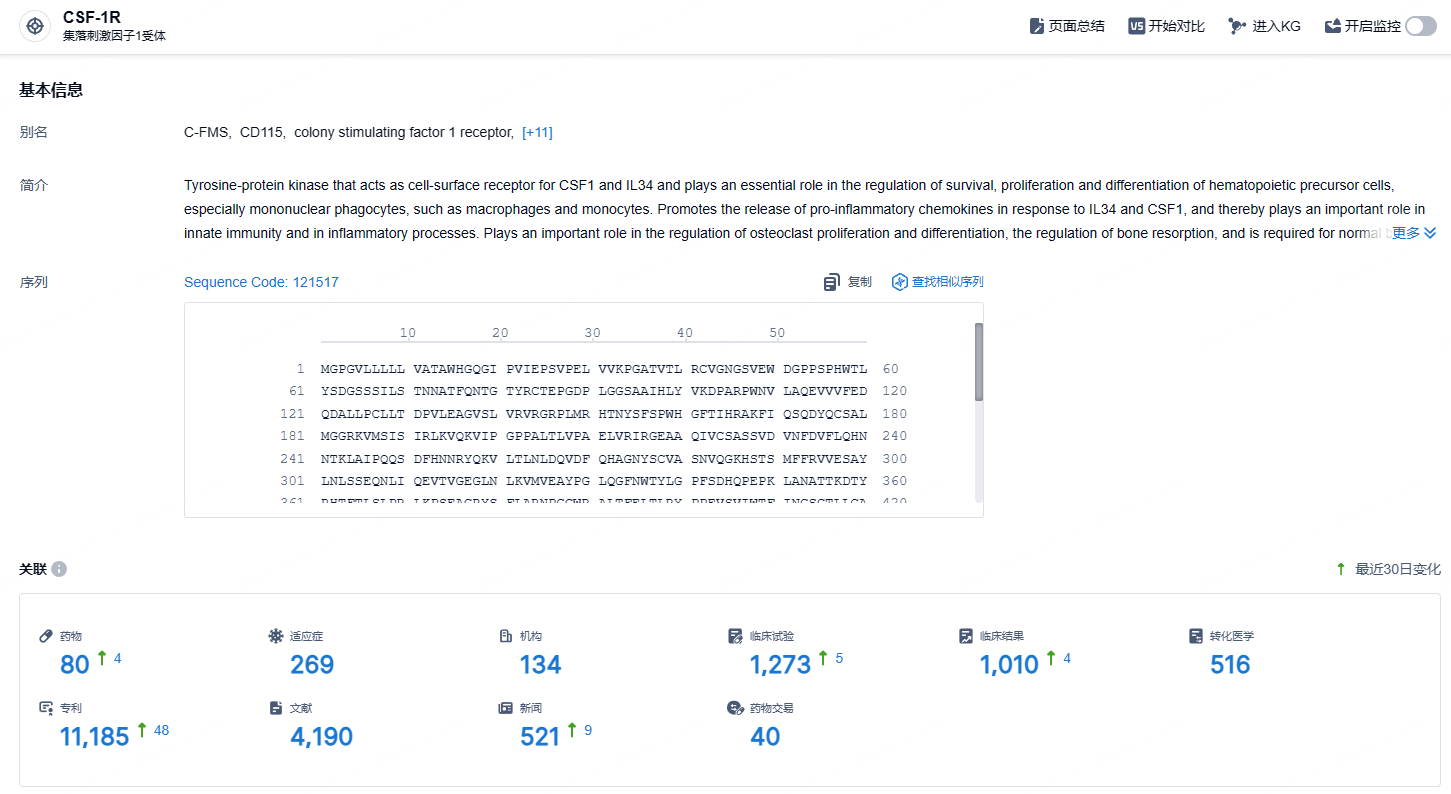
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 CSF1R 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月25日,CSF1R 靶点共有在研药物80个,包含的适应症有269种,在研机构134家,涉及相关的临床试验1273件,专利多达11185件……根据中国药物临床试验登记与信息公示平台官网,第一三共已经在中国开展了一项国际多中心(含中国)3期临床研究,该研究旨在评估pexidartinib针对伴有重度病变或严重功能限制且不能通过手术改善的有症状的TGCT成年患者的疗效和安全性。这也正是该产品本次拟纳入优先审评的适应症。吡昔替尼本次拟纳入优先审评意味着近期即将报上市,获批后将为患者带来全新的疗法选择。