英派药业PARP抑制剂塞纳帕利3期研究登上《自然》子刊,针对卵巢癌
2024年5月15日,国际医学期刊Nature Medicine发表了题为《Senaparib as first-line maintenance therapy in advanced ovarian cancer: a randomized phase 3 trial》的文章,报告了由复旦大学附属肿瘤医院吴小华教授、中山大学肿瘤防治中心刘继红教授共同牵头开展的塞纳帕利的多中心临床3期FLAMES临床研究的详细数据。
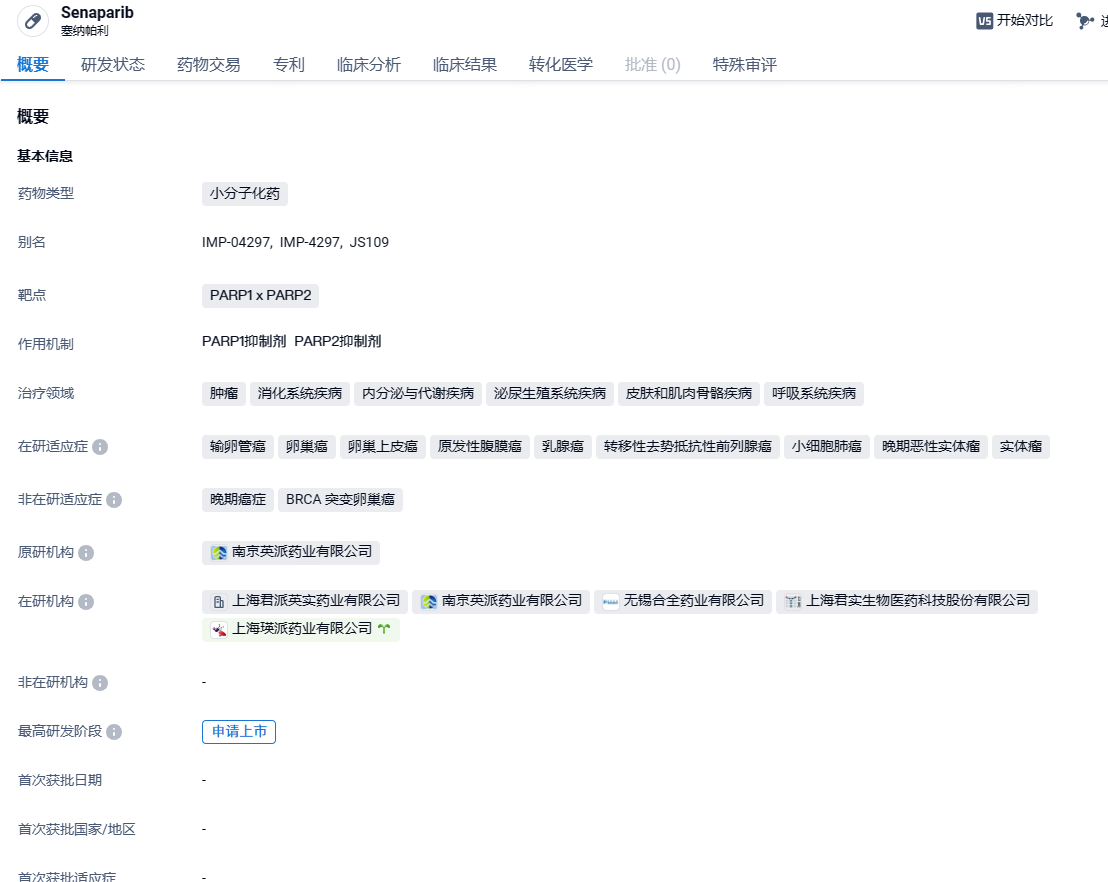
塞纳帕利(IMP4297, Senaparib)是由英派药业自主研发的新型、高效的PARP1 x PARP2抑制剂, 其独特的分子结构确保了出色的靶向选择性和广泛的安全窗口。早期临床试验显示了塞纳帕利 具有良好前景的抗肿瘤作用,包括在卵巢癌中的显著疗效。塞纳帕利在关键的3期注册研究(FLAMES)中达到了主要终点。2023年9月,英派药业宣布,国家药品监督管理局已受理 塞纳帕利在中国的新药上市申请(NDA)。2022年8月, 塞纳帕利和替莫唑胺(temozolomide, TMZ)的固定剂量组合胶囊用于治疗患有小细胞肺癌(SCLC)的成年患者, 获得美国食品药品监督管理局 (FDA)颁发孤儿药资格认定。2023年12月,英派药业与华东医药股份有限公司(SZ.000963)全资子公司杭州中美华东制药有限公司就塞纳帕利,在中国大陆的商业化推广达成合作。华东医药获得塞纳帕利在中国大陆的独家市场推广权益。
FLAMES研究纳入404名新诊断的、国际妇产科联盟(FIGO)分期III-IV期的高级别浆液性或子宫内膜样卵巢癌患者,完成一线化疗并取得完全缓解(CR)或部分缓解(PR)后按照2:1的比例,随机接受每日一次100mg的塞纳帕利或安慰剂口服治疗。主要研究终点是盲态独立中心审查(BICR)评估的无进展生存期(PFS)。研究顶线结果已在2023年以Late Breaking Oral Presentation的形式在ESMO年会上首次公布。研究结果显示,无论BRCA1和BRCA2突变状态如何,与安慰剂相比,塞纳帕利显著改善了晚期卵巢癌症患者的无进展生存期(PFS)(mPFS未达到 vs 13.6月),且耐受性良好。这些结果支持senaparib作为晚期卵巢癌症患者在一线化疗后的维持治疗。该文章还首次公布了在中国卵巢癌患者用国际通用的Myriad Genetics检测同源重组修复缺陷(HRD)的结果。结果显示,HRD阳性和阴性人群均可从塞纳帕利维持治疗中获益,为中国卵巢癌患者精准治疗提供了重要的参考价值。
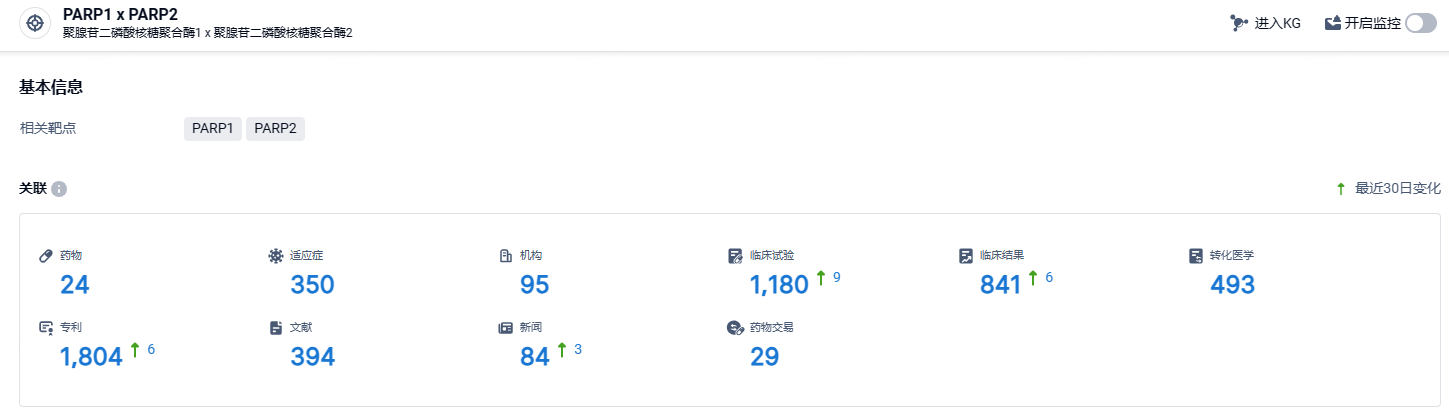
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达PARP1 x PARP2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月16日,PARP1 x PARP2靶点共有在研药物24个,包含的适应症有350种,在研机构95家,涉及相关的临床试验1180件,专利多达1804件……2023年8月,国家药监局(NMPA)受理了塞纳帕利的新药上市申请,适用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者对一线含铂化疗达到完全缓解或部分缓解后的维持治疗。期待该药早日成功获批。