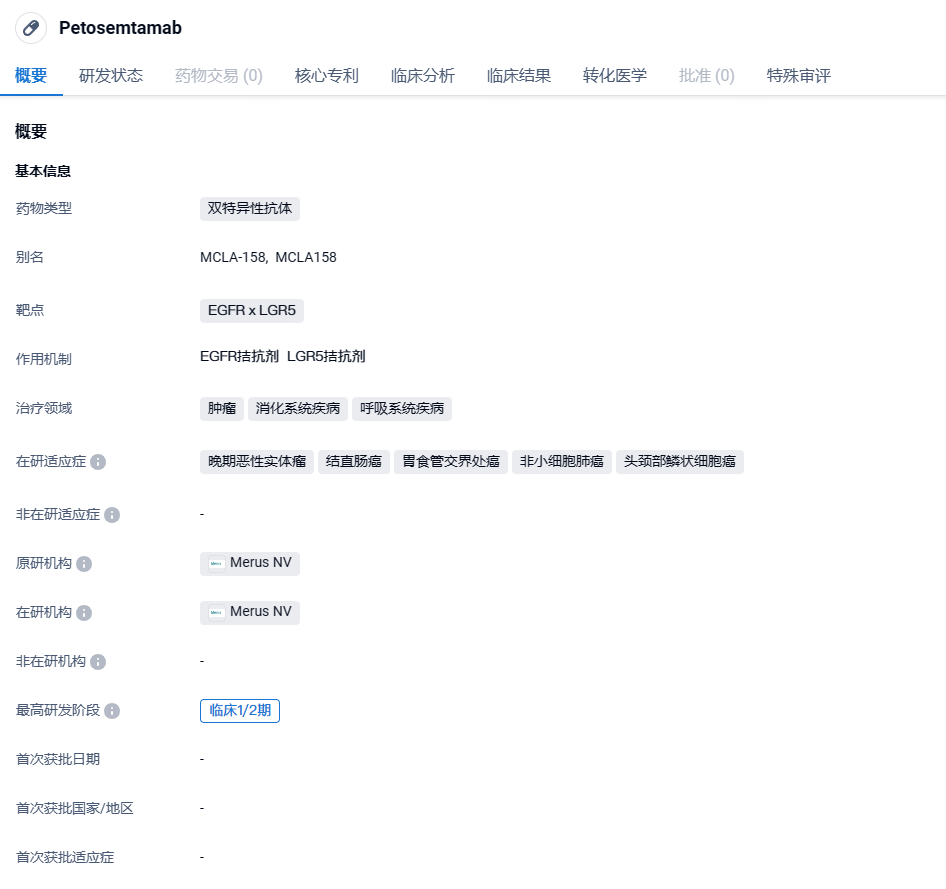
Merus:EGFR/LGR5双抗petosemtamab获FDA突破性疗法认定,针对HNSCC
2024年5月14日,Merus宣布,美国FDA已授予其在研EGFR x LGR5双特异性抗体petosemtamab突破性疗法认定(BTD),用于治疗复发性或转移性头颈部鳞状细胞癌(HNSCC)患者,这些患者在接受铂类化疗和PD-1或PD-L1靶向抗体治疗后病情出现进展。
petosemtamab是一种双特异性Biclonics®低岩藻糖全人源IgG1抗体,它同时靶向表皮生长因子受体(EGFR)和富含亮氨酸重复序列的G蛋白偶联受体5(LGR5)。Petosemtamab 设计上具有三种独立的作用机制:
①抑制依赖于EGFR的信号传导通路:通过与肿瘤细胞表面的EGFR结合,阻断其正常的信号传递,从而抑制肿瘤细胞的增殖、迁移和血管生成等过程。
②LGR5介导的EGFR内化和降解:Petosemtamab能够与LGR5结合,进而导致癌细胞内的EGFR被内吞并降解,进一步削弱EGFR的促癌活性。
③增强抗体依赖性细胞介导的细胞毒性和吞噬作用(ADCC/ADCP):通过其双特异性结构,Petosemtamab能够招募并激活免疫系统的自然杀伤细胞(NK细胞)和巨噬细胞,增强它们对表达EGFR和LGR5的癌细胞的识别和清除能力,实现间接的抗肿瘤效应。
该突破性疗法认定是基于进行中的开放标签、多中心1/2期临床试验的数据支持,该试验评估petosemtamab作为单药,治疗在包括经治的(复发性或转移性)HNSCC在内的晚期实体瘤患者。根据Merus之前公布的petosemtamab初步1/2期临床研究数据,43名接受该疗法治疗并纳入分析患者的总缓解率(ORR)为37.2%(n=16/43,95% CI:23.0-53.3),疾病控制率(DCR)为72.1%(n=31/43,95% CI:56.3-84.7)。患者的中位生存期(OS)为11.5个月(n=29/49,95% CI:7.2-20.6)。过往数据显示,对铂类药物和PD-1或PD-L1疗法耐药的HNSCC患者,他们对现有2线疗法的ORR为5-13%,中位生存期约为6个月。Merus计划在2024年下半年提供该队列更新的疗效、持久性和安全性数据
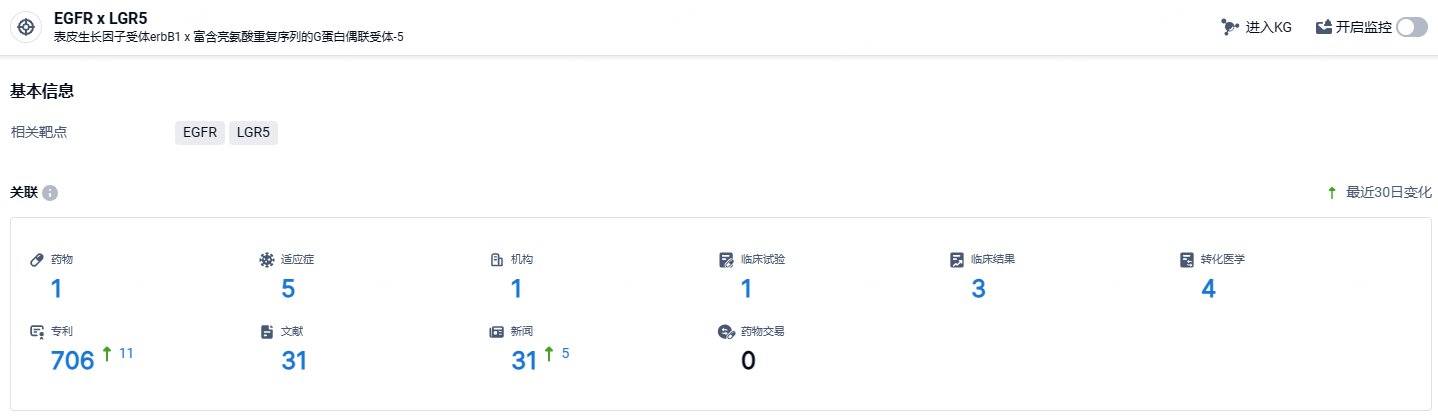
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达EGFR x LGR5靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月16日,EGFR x LGR5靶点共有在研药物1个,包含的适应症有5种,在研机构1家,涉及相关的临床试验1件,专利多达706件……petosemtamab的安全性被视为可管理,更多的疗效、耐久性和安全性数据预计将在2024年下半年的ASCO年会上更新。此临床研究强调了Petosemtamab作为一种潜在的创新治疗方法在头颈癌治疗领域的重要性。期待petosemtamab后续临床能够进展顺利。