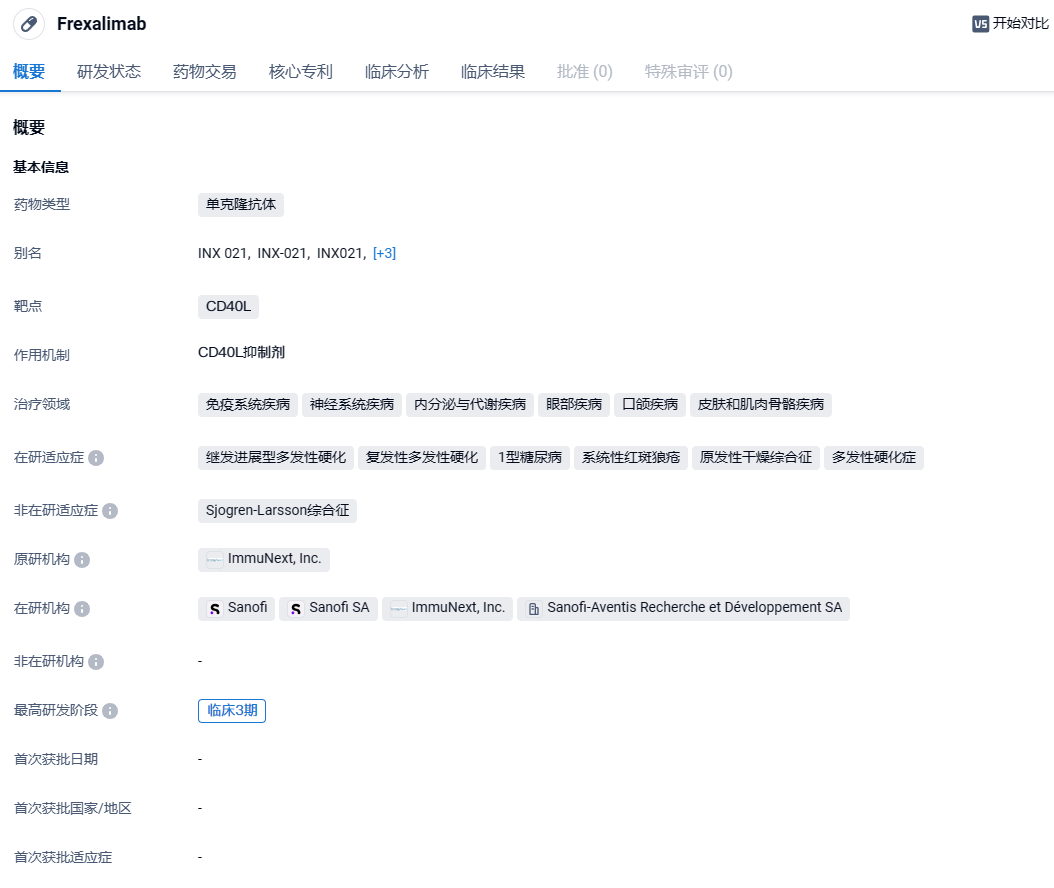
赛诺菲抗CD40L单抗SAR441344启动中国III期临床,针对多发性硬化
2024年5月13日,药物临床试验登记与信息公示平台显示,赛诺菲的抗CD40L单抗SAR441344(frexalimab)在中国启动了III期临床试验,旨在评估SAR441344在非复发性继发进展型多发性硬化成人患者中的安全性和有效性。
Frexalimab(SAR441344)是一种靶向CD40L的新型单克隆抗体,最早由ImmuNext开发,被认为能够阻断适应性(T和B细胞)和先天性(巨噬细胞和树突状细胞)免疫细胞活化和功能所必需的共刺激CD40/CD40L细胞通路,而无需进行淋巴细胞清除。2017年,赛诺菲和ImmuNext签订一项全球独家授权协议,获得INX-021(SAR441344,frexalimab)在狼疮和多发性硬化症等一系列自身免疫性疾病领域的开发权益。为此,赛诺菲将向ImmuNext支付的潜在里程碑付款总额可能会达到5亿美元,以及高达两位数的产品销售额分级特许权使用费。2024年4月17日,中国国家药监局药品审评中心(CDE)官网公示,赛诺菲(Sanofi)1类新药frexalimab注射液获得两项临床试验默示许可,分别拟开发治疗成人复发型多发性硬化(RMS)、成人非复发性继发进展型多发性硬化症(nrSPMS)。
2023年5月31日,赛诺菲在2023年多发性硬化中心联盟 (CMSC) 年会上公布了 CD40L抗体frexalimab治疗复发性多发性硬化症 (MS) 的积极数据,II 期研究达到了主要终点,计划在 2024 年开始关键试验。结果显示,经过 12 周的治疗,新的 与安慰剂相比,高剂量和低剂量治疗组的钆增强 (GdE) T1 病变分别显著减少了 89% 和 79%。
此次公布的II 期试验是一项随机双盲、安慰剂为对照的试验,目的为评估在复发性MS患者中使用frexalimab的效果。结果显示,经过12周的治疗,frexalimab相较于安慰剂,新的钆增强(GdE)T1病变数量分别在高剂量和低剂量治疗组中减少了89%和79%,达到了研究的主要终点。MS仍然存在大量未满足的需求,需要高效且耐受性良好的治疗方案以可持续地控制疾病活动和残疾进展,同时最大限度地降低风险。
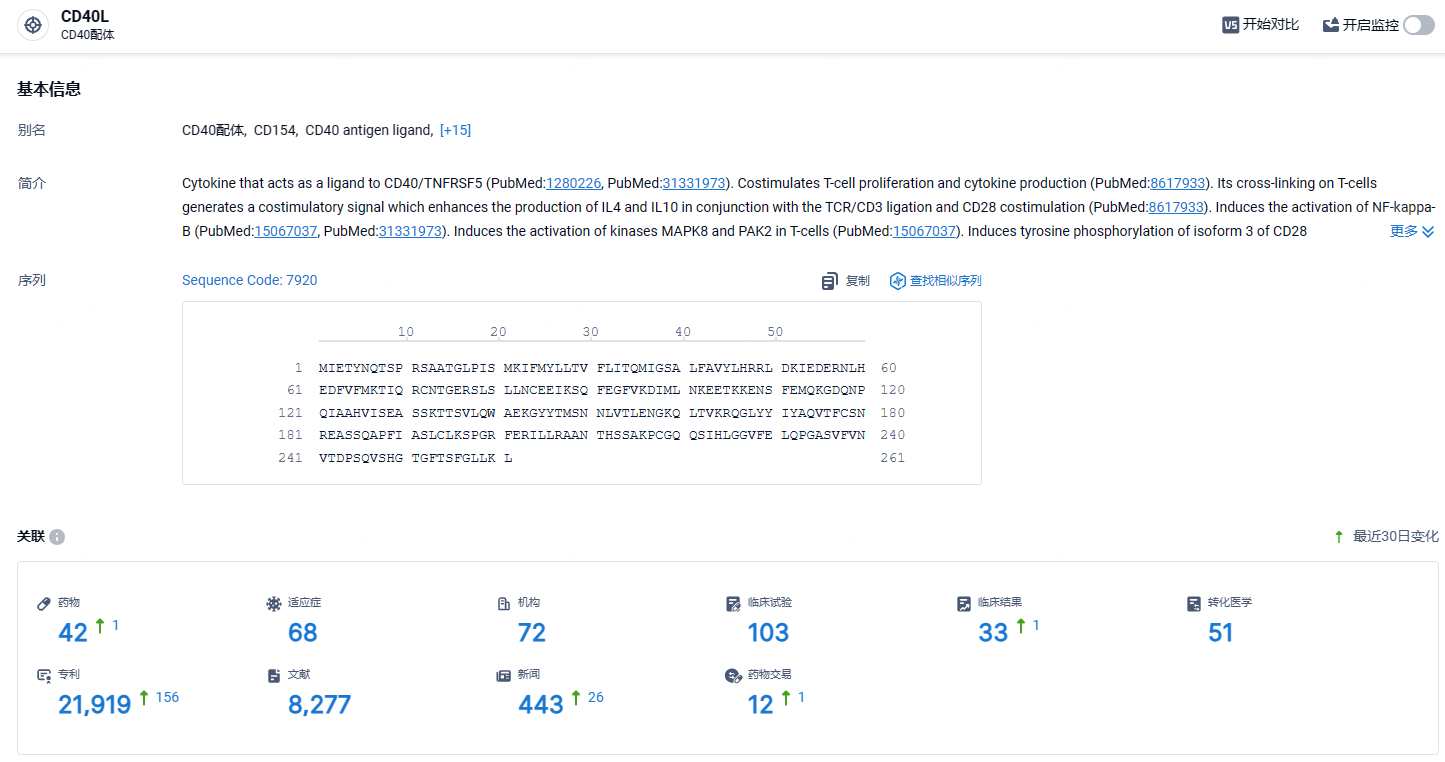
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 CD40L 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月14日,CD40L 靶点共有在研药物42个,包含的适应症有68种,在研机构72家,涉及相关的临床试验103件,专利多达21919件……目前国内布局该靶点的药企相对较少,期待该领域出现更多的中国元素。