先为达口服长效GLP-1R激动剂伊诺格鲁肽1期临床获积极结果,面准降糖/减重千亿市场
2024年1月24日,先为达宣布口服长效GLP-1R激动剂伊诺格鲁肽片剂1期临床试验已完成的4个试验组取得积极结果。
伊诺格鲁肽(Ecnoglutide,XW003)是由先为达生物研发的一种具有偏向性的新型长效GLP-1R激动剂,经优化后可实现每周给药一次,且在生物活性和生产成本效益方面均有所提高,拟开发治疗2型糖尿病、肥胖症和非酒精性脂肪性肝炎(NASH)。已完成的临床研究证实,Ecnoglutide对2型糖尿病和肥胖症患者具有优良的治疗效果,并显示出良好的安全性和耐受性。2024年1月3日,先为达公布了该公司长效GLP-1R激动剂Ecnoglutide(XW003)治疗中国成人2型糖尿病(T2DM)患者III期临床试验的积极结果。
这项1期临床试验是一项随机、双盲、安慰剂对照的多次剂量递增研究。口服伊诺格鲁肽的目标剂量在第1-3试验组分别为7mg、15mg或30mg,为期2周;在第4试验组的目标剂量为30mg,为期6周,其中包含剂量递增期。该研究主要评估指标包括口服伊诺格鲁肽的安全性、耐受性、药代动力学和受试者平均体重相对基线的变化。研究显示,口服伊诺格鲁肽的总体安全性和耐受性与肽类GLP-1激动剂的已知安全性特征一致。最常见的不良事件包括恶心、头痛、腹泻、呕吐和食欲减退,大多数不良事件的严重程度为轻中度,主要发生在剂量递增期。
此前公布的III期临床试验(NCT05680155)是一项多中心、随机、双盲、安慰剂对照研究,在中国33家临床试验中心共计招募211名受试者,均为饮食运动干预后血糖控制不佳的成年2型糖尿病患者。受试者随机接受每周一次0.6 mg、1.2 mg Ecnoglutide或安慰剂治疗24周(含剂量递增期),研究的主要疗效终点为治疗24周后糖化血红蛋白(HbA1c)相对基线的改变。受试者在完成24周双盲治疗后进入开放治疗期,继续接受目标剂量0.6 mg或1.2 mg Ecnoglutide的治疗,总治疗期为52周。本研究评估项目包括受试者平均HbA1c、体重、体重指数(BMI)等的变化,以及药物的安全性与耐受性。受试者的基线平均HbA1c为8.5%,平均体重为73公斤。治疗24周后,Ecnoglutide显著降低了受试者HbA1c水平,大多数受试者HbA1c低于7%(美国糖尿病协会推荐的糖尿病患者治疗目标),相当一部分降低至正常水平范围(低于5.7%)。同时,Ecnoglutide组受试者的体重也显著下降。
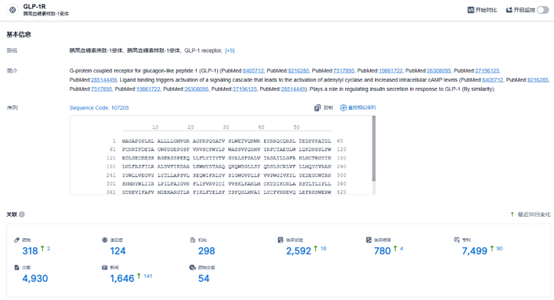
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年1月25日,GLP-1R靶点共有在研药物314个,包含的适应症有72种,在研机构277家,涉及相关的临床试验2560件,专利多达7414件……GLP-1受体新药在降糖、减重等领域有着非常大的治疗潜力,期待相关国产新药能够研发顺利。




