FDA接受新一代CD19 CAR-T疗法obe-cel上市申请,76%患者获完全缓解!
近日,Autolus Therapeutics公司宣布,美国FDA已经接受了其为CAR-T疗法obecabtagene autoleucel(obe-cel)递交的生物制品许可申请(BLA),用于治疗复发/难治性B细胞急性淋巴细胞白血病(ALL)成人患者。FDA预计在今年11月16日之前给出审评结果。
Obecabtagene Autoleucel(Obe-cel)是Autolus Therapeutics开发的一种可快速解离CD19结合域的自体CD19 CAR-T。Obe-cel的独特之处在于,设计的嵌合抗原受体在与CD19结合后具有较快的解离速度(fast off-rate),从而能够尽量减少T细胞的过度激活,在降低毒副作用的同时,不易发生T细胞耗竭,提高CAR-T疗法的持久性。Obe-cel已被美国FDA和EMA授予孤儿药资格,并获得了美国FDA授予的先进再生医学疗法(RMAT)认定、以及EMA授予的PRIME认定,用于治疗成人r/r B-ALL。2023年11月,Autolus Therapeutics宣布已向美国FDA提交了其CAR-T细胞疗法obecabtagene autoleucel(obe-cel)的生物制品许可申请(BLA),用于治疗复发/难治性(r/r)成人B细胞急性淋巴细胞白血病(B-ALL)患者。
这一BLA申请是基于obe-cel的关键性2期临床试验FELIX的数据。试验结果显示,在接受治疗的94位患者中,76%的患者获得完全缓解(CR)或CR伴不完全的血液学恢复(CRi)。在这一患者队列中,112名成年患者入组,其中94名患者接受了治疗。在获得缓解的患者中,97%的患者没有检测到最小残留病(MRD)。此外,在中位随访期为9.5个月时,61%获得缓解的患者在没有接受新抗癌疗法治疗的情况下仍然维持缓解。Autolus计划在2024年上半年向欧洲药品管理局(EMA)提交obe-cel治疗复发/难治性急性淋巴细胞性白血病的上市许可申请。
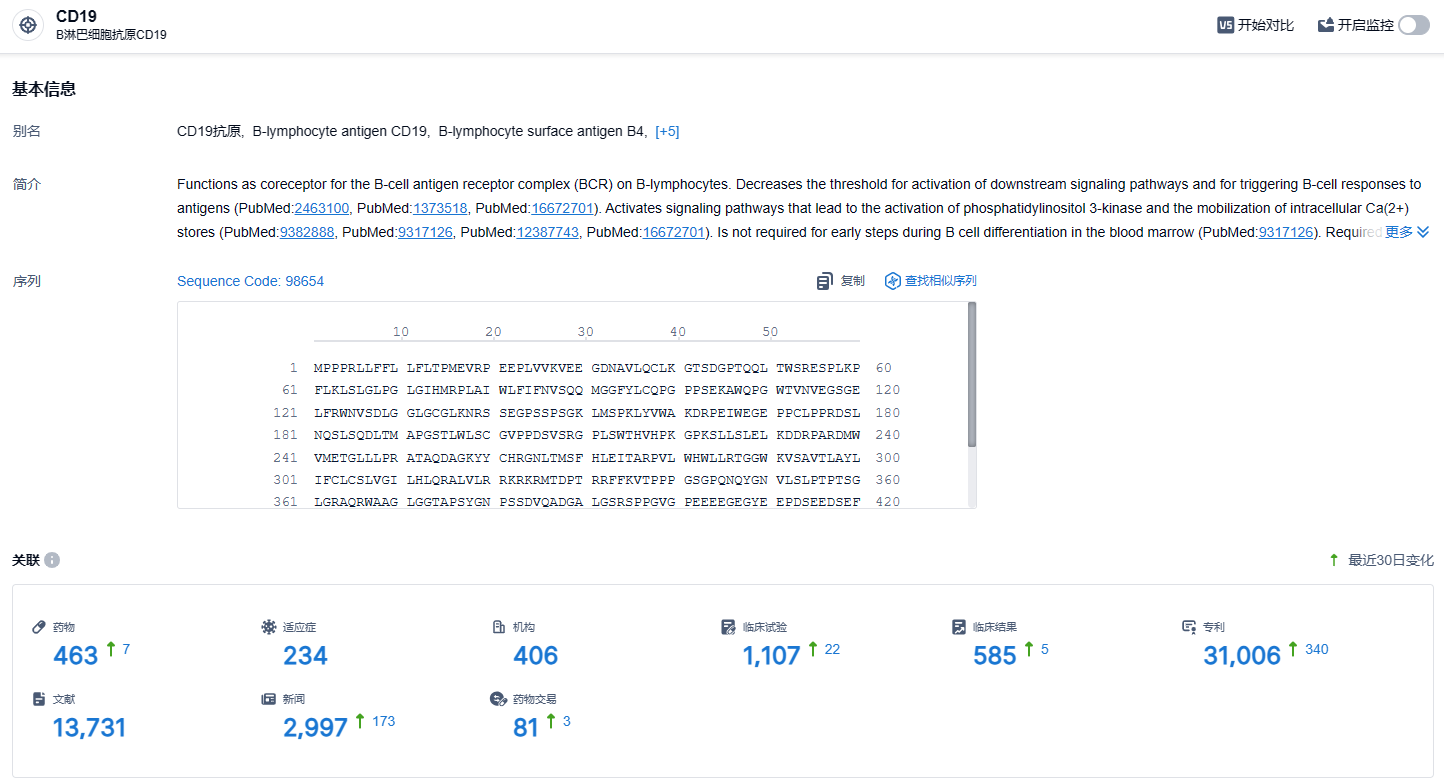
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月25日,CD19靶点共有在研药物463个,包含的适应症有234种,在研机构406家,涉及相关的临床试验1107件,专利多达31006件……obe-cel已获得孤儿药资格、FDA的再生医学先进疗法(RMAT)认定以及EMA的PRIME认定,显示了其在治疗复发/难治性急性淋巴细胞白血病方面的潜力。期待这款CAR-T疗法早日上市。