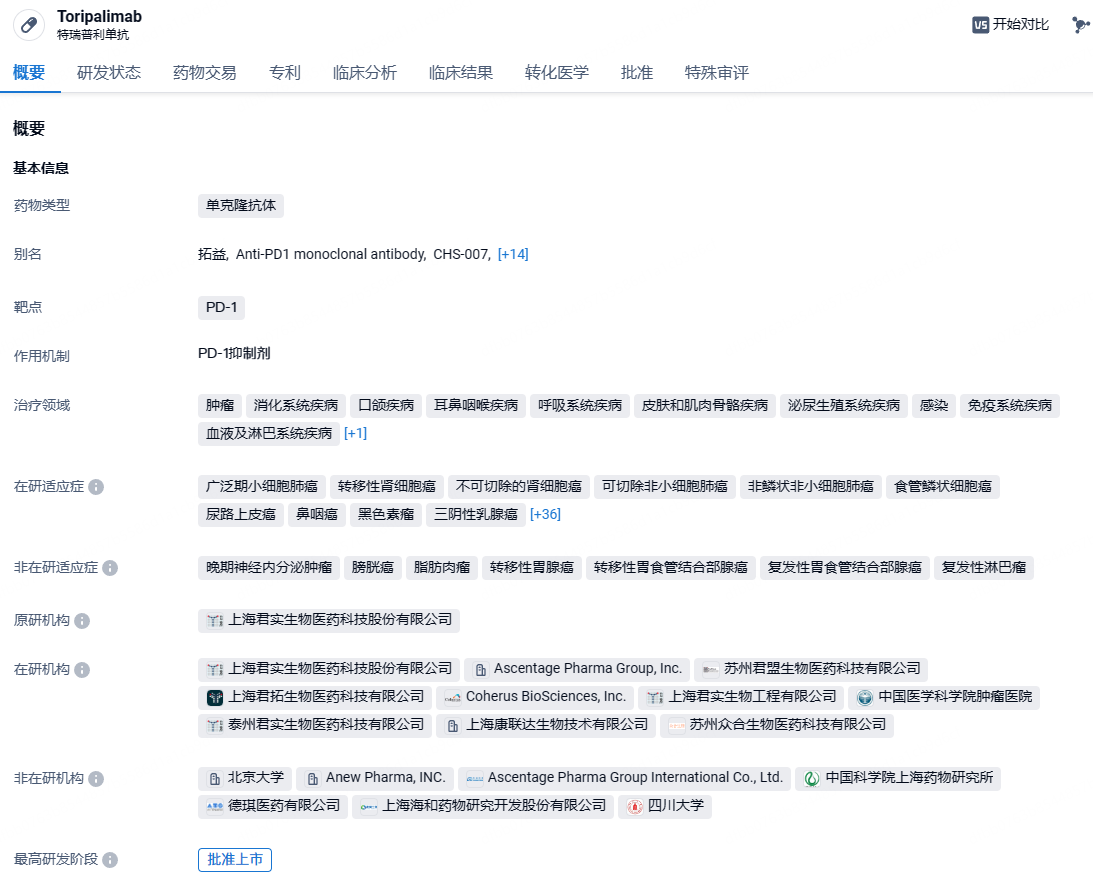
君实PD-1特瑞普利单抗在欧盟获批上市,针对鼻咽癌和食管鳞癌
9月24日,君实生物宣布,其自主研发的抗PD-1单抗药物特瑞普利单抗(欧洲商品名:LOQTORZI)于近日获得欧盟委员会(EC)批准用于治疗两项适应症:特瑞普利单抗联合顺铂和吉西他滨用于复发、不能手术或放疗的,或转移性鼻咽癌(NPC)成人患者的一线治疗;特瑞普利单抗联合顺铂和紫杉醇用于不可切除的晚期/复发或转移性食管鳞癌(ESCC)成人患者的一线治疗。此次获批适用于欧盟全部27个成员国以及冰岛、挪威和列支敦士登,使得特瑞普利单抗成为欧洲首个且唯一用于NPC治疗的药物,也是欧洲唯一用于不限PD-L1表达的晚期或转移性ESCC一线免疫治疗药物。
特瑞普利单抗是我国批准上市的首个国产以PD-1为靶点的单抗药物,由本土创新药企君实生物独立研发,用于多种恶性肿瘤治疗。至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由君实生物发起的临床研究。截至目前,特瑞普利单抗已在中国内地获批8项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非小细胞肺癌、肾癌等,并在美国获批鼻咽癌适应症。此外,该产品用于PD-L1阳性的初治转移或复发转移性三阴性乳腺癌的新适应症上市申请也正在审评中。在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。2023年10月,君实生物与Coherus BioSciences共同宣布,特瑞普利单抗(商品名LOQTORZI)在美国获FDA批准上市,成为FDA批准的首个也是目前唯一一个用于鼻咽癌的PD-1单抗。
本次EC对于NPC和ESCC适应症的批准分别基于JUPITER-02和JUPITER-06研究的积极结果。
JUPITER-02研究是鼻咽癌免疫治疗领域首个国际多中心、样本量最大的双盲、随机对照III期临床研究,也是全球首个鼻咽癌一线免疫联合化疗对比单纯化疗将总生存期(以下简称“OS”)预设有统计学检验(一类错误控制)并确证具有生存获益的III期临床研究。研究结果显示,与单纯化疗相比,特瑞普利单抗联合化疗使患者的疾病进展风险降低48%,死亡风险降低37%。特瑞普利单抗联合化疗组的中位无进展生存期(以下简称“PFS”)对比单纯化疗延长了13.2个月,从8.2个月提升至21.4个月。此外,接受该联合疗法治疗的患者可获得更高的客观缓解率(ORR),更长的持续缓解时间(DoR)和更高的疾病控制率(DCR),且未发现新的安全性信号。长期生存随访数据在2024年ASCO年会展示,特瑞普利单抗治疗组5年生存率达到52%。
本次食管鳞癌适应症的获批主要基于JUPITER-06(一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究,NCT03829969)的研究结果。该研究旨在评估与安慰剂联合化疗相比,特瑞普利单抗联合紫杉醇/顺铂(TP)用于晚期食管鳞癌一线治疗的疗效及安全性。研究结果显示,特瑞普利单抗联合化疗可使晚期或转移性食管鳞癌患者获得更优的PFS和OS,其中中位OS延长6个月,达到17个月,并显著降低患者的疾病进展或死亡风险达42%,显著改善生存获益,且无论PD-L1表达如何均可获益。
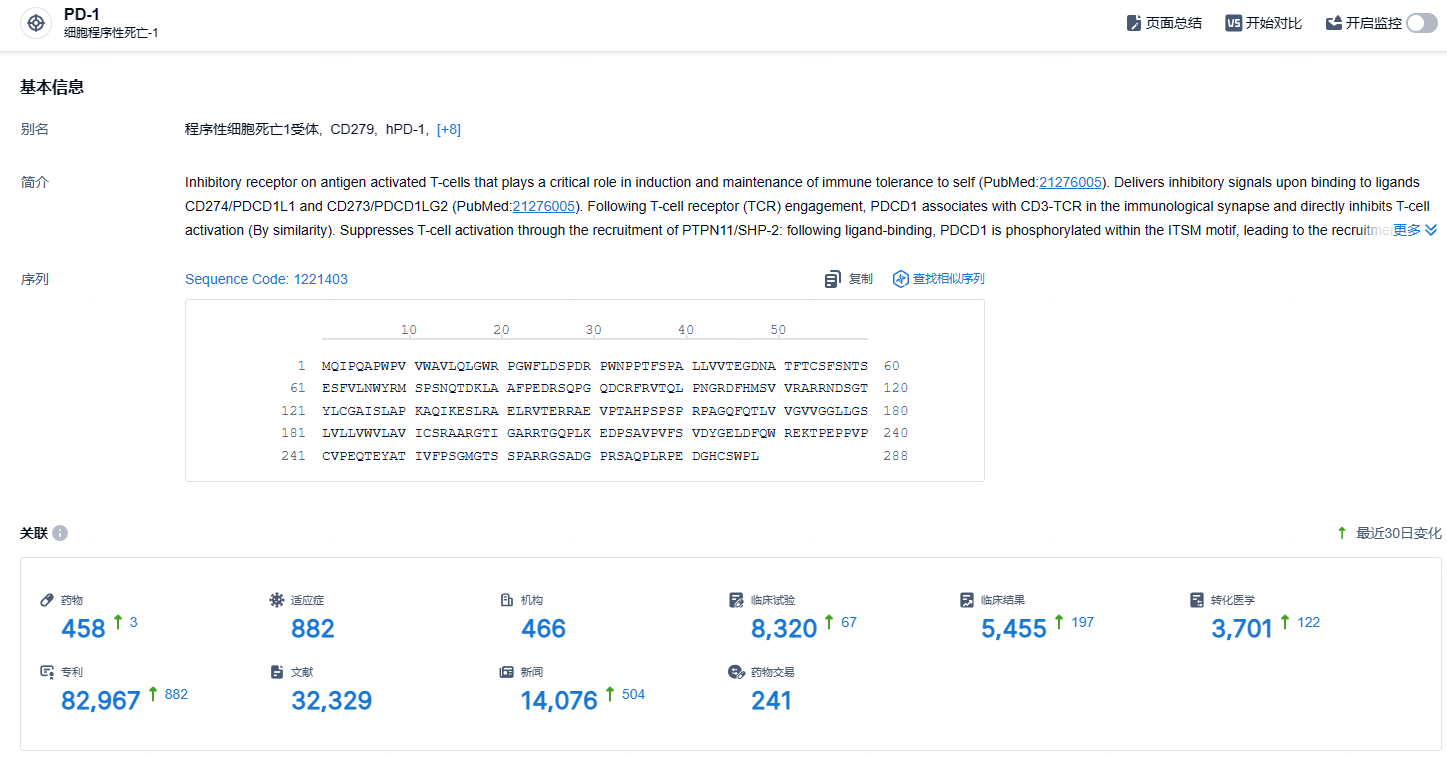
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年9月26日,PD-1 靶点共有在研药物458个,包含的适应症有882种,在研机构466家,涉及相关的临床试验8320件,专利多达82967件……PD-1靶点是研发非常火热的领域,君实的特瑞普利单抗是国产新药的明星产品,也是国产新药出海的典范,期待该药的后续表现。