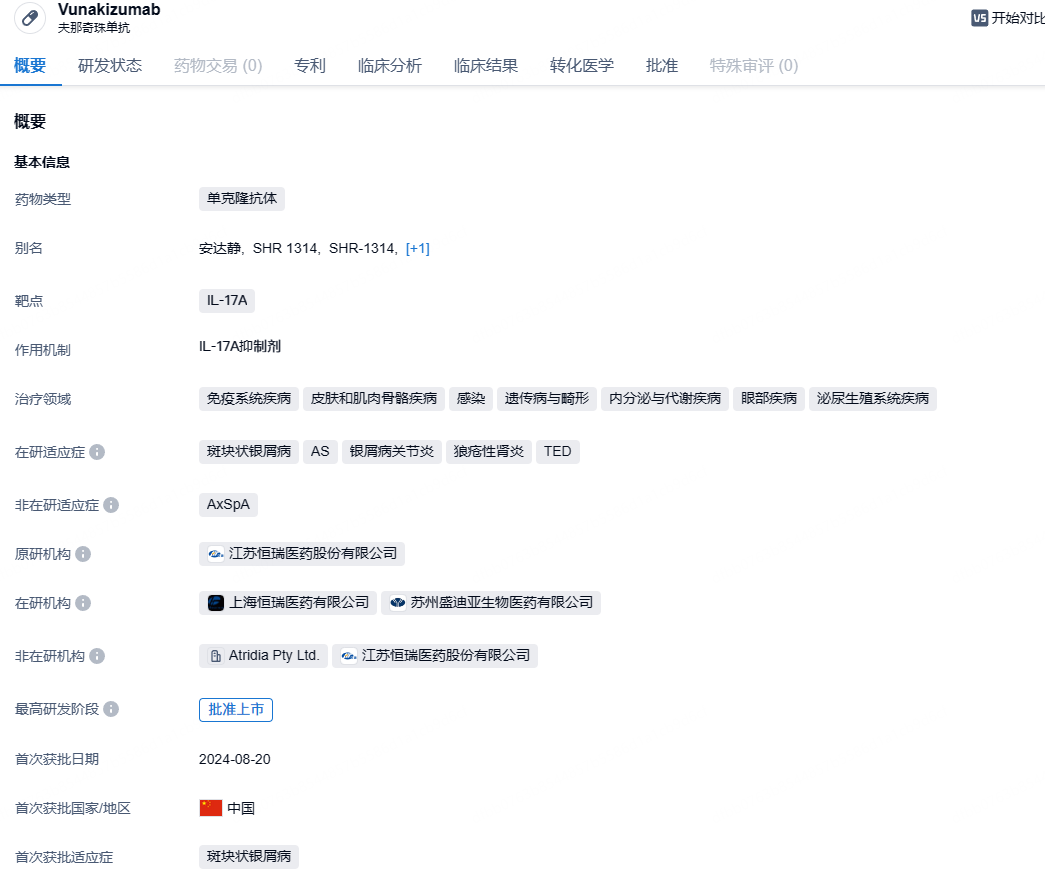
恒瑞医药IL-17A单抗夫那奇珠单抗获批新适应症,治疗强直性脊柱炎
10月29日,NMPA官网显示,恒瑞医药的夫那奇珠单抗(Vunakizumab,SHR-1314)新适应症获批。此次获批的适应症为强直性脊柱炎。
夫那奇珠单抗是恒瑞医药自主研发的一种靶向人IL-17A的重组人源化单克隆抗体,拟用于治疗与IL-17通路相关的自身免疫疾病,可与IL-17A结合,阻断其与IL-17R的相互作用,导致下游炎性信号传导的阻断。SHR-1314注射液目前已开展了包括斑块状银屑病、银屑病关节炎、强直性脊柱炎等临床研究,以评估其对多种自身免疫性疾病的作用。其中斑块状银屑病的研究已完成,并达到了主要研究终点及关键次要研究终点,其上市许可申请已于2023年4月获得国家药监局受理。今年8月,夫那奇珠单抗与智翔金泰赛立奇单抗同日获批,用于治疗成人中重度斑块型银屑病,并列成为首款获批的国产IL-17A单抗。此外,恒瑞还在今年2月递交了夫那奇珠单抗的第2个适应症上市申请(CXSS2400017/8/9),用于治疗成人活动性强直性脊柱炎。夫那奇珠单抗本次启动Ⅲ期临床的是一项新适应症——治疗儿童及青少年中重度慢性斑块状银屑病。
在2024欧洲抗风湿病联盟(EULAR)年会上,公布了一项有关夫那奇珠单抗治疗强直性脊柱炎的研究成果。该研究是一项多中心、随机、双盲、安慰剂对照的适应性无缝Ⅱ/Ⅲ期临床研究,纳入活动性强直性脊柱炎(AS)受试者,研究分为第一阶段(Ⅱ期)和第二阶段(Ⅲ期),在Ⅱ期试验中,受试者按2∶2∶1随机分组,分别在第0、2、4、8和12周时接受夫那奇珠单抗120mg、240mg或安慰剂治疗。
第16周,夫那奇珠单抗120mg组的ASAS 20应答率为65.6%,显著高于安慰剂组的42.5%,组间差异23.2%(P<0.0001),见图2A;与安慰剂组相比,夫那奇珠单抗120mg组在ASAS 40(46.3% vs. 24.0%,P<0.0001)和ASAS 5/6应答(55.4% vs. 22.6%;P<0.0001)方面也有明显改善。第16周,夫那奇珠单抗120mg组BASDAI评分(-2.72 vs. -1.82;P<0.0001)、BASFI评分(-1.66 vs. -0.96;P<0.0001)、BASMI评分(-0.31 vs. -0.15;P=0.0057)、ASQoL评分(-4.05 vs. -2.70;P=0.0002)、SF-36 PCS评分(6.33 vs. 3.57,P<0.0001)较基线的改善均大于安慰剂组的受试者。夫那奇珠单抗120mg组的ASAS应答维持至32周。研究表明夫那奇珠单抗120mg在第16周时较安慰剂显著改善了强直性脊柱炎受试者的症状和体征,疗效持续至32周,且安全可耐受。
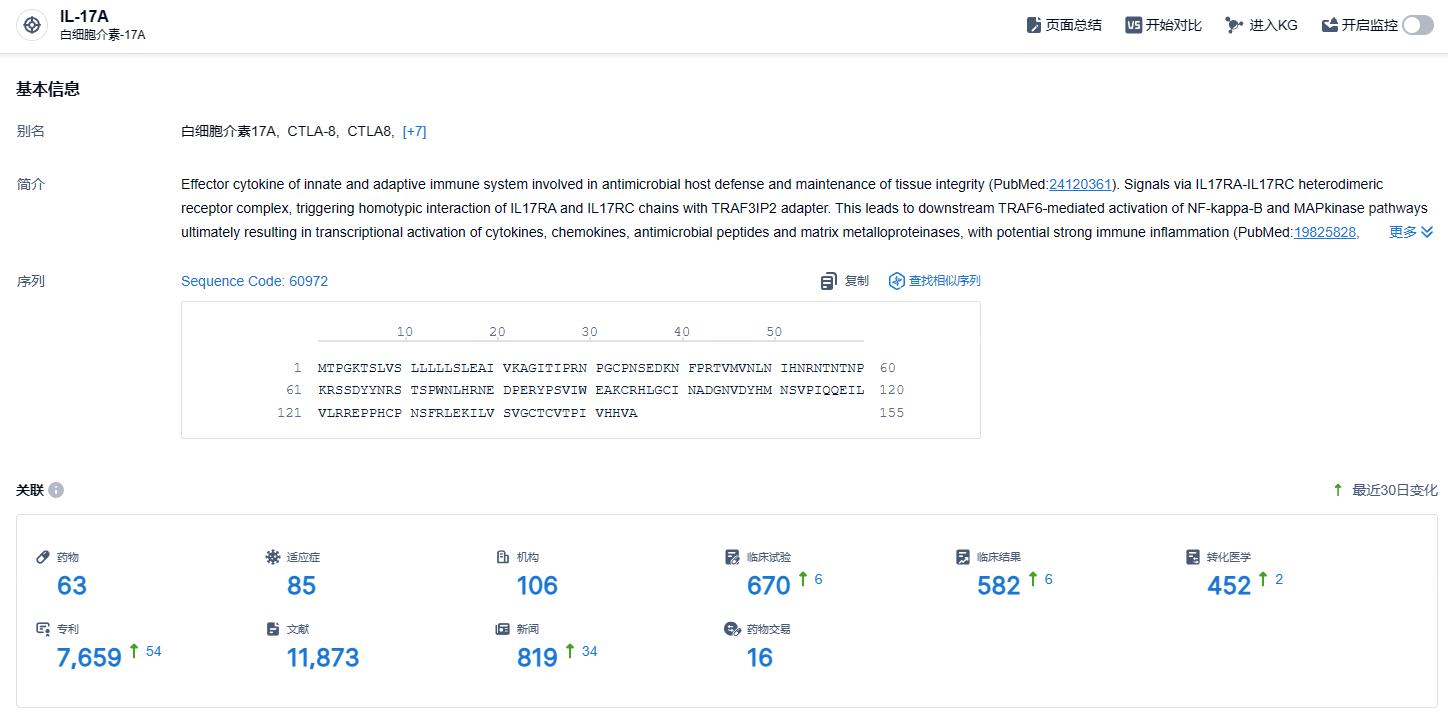 根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-17A靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年10月30日,IL-17A靶点共有在研药物63个,包含的适应症有85种,在研机构106家,涉及相关的临床试验670件,专利多达7659件……IL-17A 是炎症、自身免疫性疾病领域的热门靶点,具有巨大的治疗潜力和广阔的市场前景。截至目前,夫那奇珠单抗相关项目累计已投入研发费用约 3.68亿元。期待夫那奇珠单抗能够商业化顺利,为国内自身免疫患者带来新的治疗选择。
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-17A靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年10月30日,IL-17A靶点共有在研药物63个,包含的适应症有85种,在研机构106家,涉及相关的临床试验670件,专利多达7659件……IL-17A 是炎症、自身免疫性疾病领域的热门靶点,具有巨大的治疗潜力和广阔的市场前景。截至目前,夫那奇珠单抗相关项目累计已投入研发费用约 3.68亿元。期待夫那奇珠单抗能够商业化顺利,为国内自身免疫患者带来新的治疗选择。