Tyra Biosciences旗下FGFR3抑制剂TYRA-300公布临床1/2期结果,治疗尿路上皮癌
10月27日,Tyra Biosciences公布其在研潜在“first-in-class”FGFR3靶向抑制剂TYRA-300在SURF301临床1/2期研究中治疗转移性尿路上皮癌(mUC)患者的临床概念验证数据。
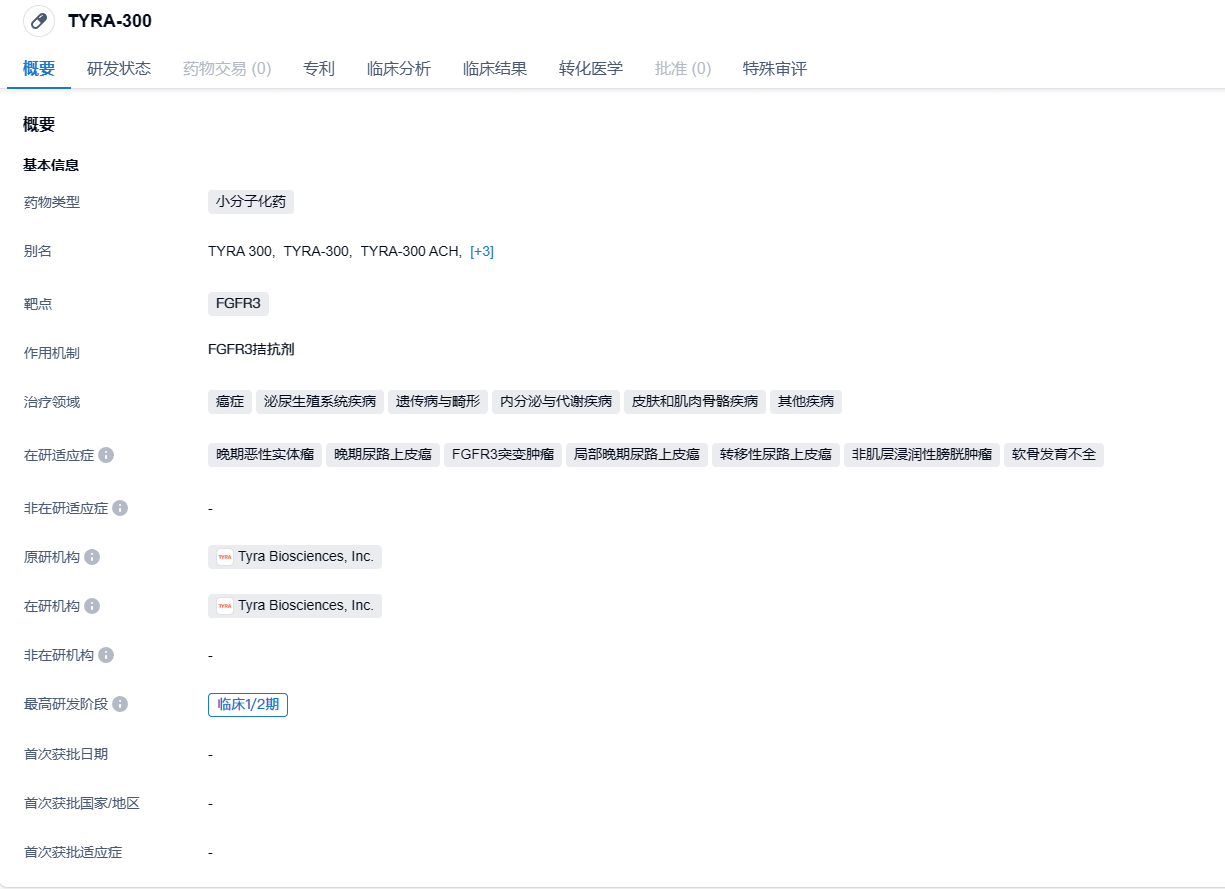
TYRA-300是一种研究性口服FGFR3选择性抑制剂,目前正在开发中,用于治疗癌症和骨骼发育异常,包括软骨发育不全。TYRA-300正在一项多中心、开放标签的1/2期临床研究SURF301(未治疗和耐药的FGFR3+晚期实体瘤研究)中进行评估。SURF301旨在确定TYRA-300的最佳和最大耐受剂量(MTD)以及推荐的2期剂量(RP2D),并评估TYRA-300的初步抗肿瘤活性。SURF301目前正在招募患有晚期尿路上皮癌和其他FGFR3基因改变的实体瘤的成年人。在骨骼发育不良方面,TYRA-300已显示出积极的临床前结果。
截至2024年8月15日,SURF301研究的1期部分共入组41名mUC患者,患者可携带或不携带FGFR3突变,且包括曾接受获批FGFR抑制剂erdafitinib治疗的患者。入组患者之前接受过大量治疗,其中44%患者在接受TYRA-300之前已接受了≥3线治疗,76%的带有FGFR3变异的mUC患者接受了≥3线治疗。分析显示,接受每日一次≥90 mg TYRA-300、带有FGFR3突变(FGFR3+)的患者达成100%的疾病控制率(DCR),11名接受每日一次≥90 mg剂量的患者中,6人(54.5%)达到部分缓解(PR),其中3人缓解仍在持续。
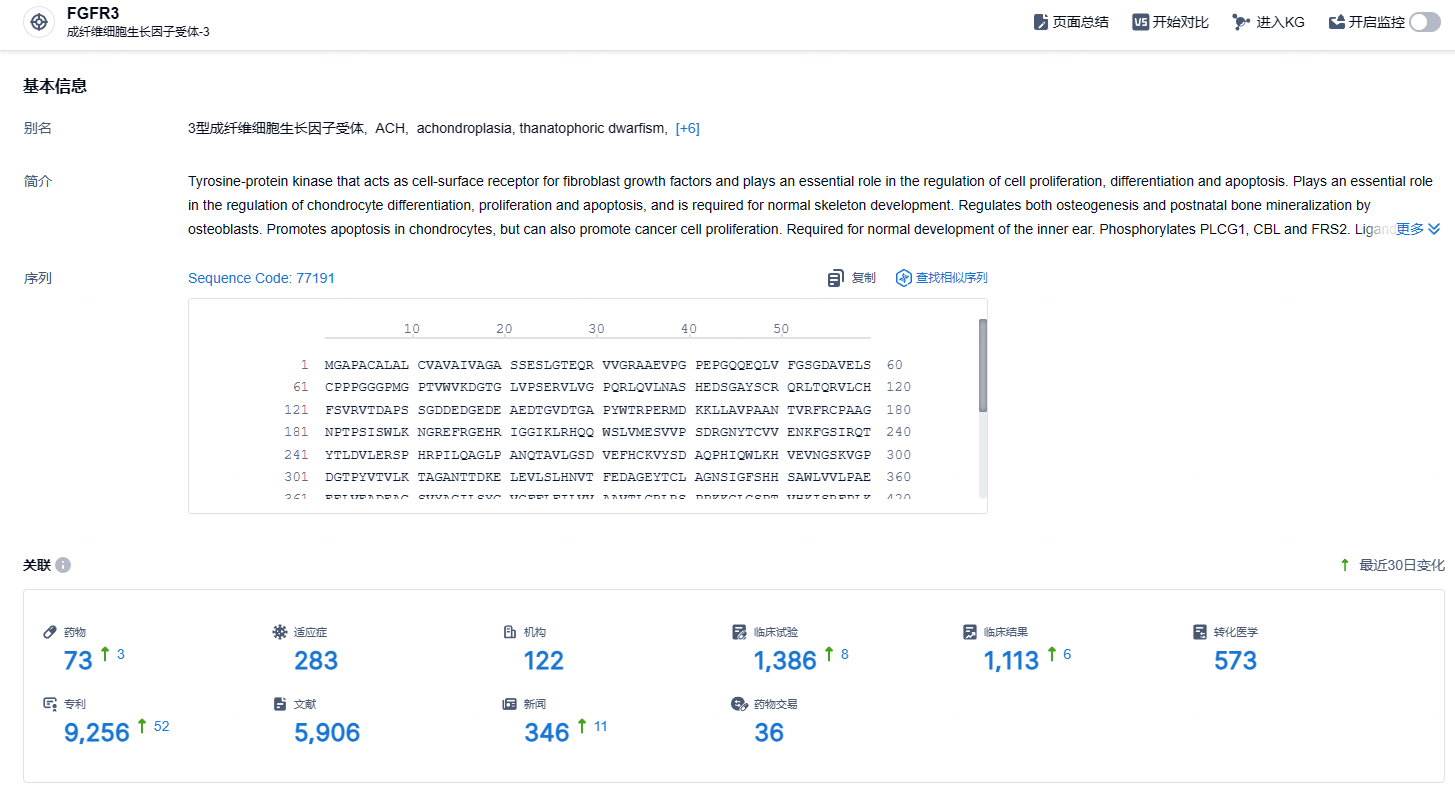
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 FGFR3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年10月29日,FGFR3靶点共有在研药物73个,包含的适应症有283种,在研机构122家,涉及相关的临床试验1386件,专利多达9256件……FGFR3基因不仅对正常的骨骼发育至关重要,而且其突变也与多种遗传性疾病和癌症的发生相关。因此,研究FGFR3基因及其突变不仅能帮助我们理解骨骼生长的机制,还能为相关疾病的诊断和治疗提供重要的线索。期待TYRA-300后续进展顺利,早日获批。