FDA拒绝批准Mesoblast异体来源间充质干细胞疗法remestemcel-L上市
2023年8月4日,Mesoblast宣布收到FDA就间充质干细胞疗法remestemcel-L用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者的生物制品许可申请(BLA)发出的完整回复信(CRL)。FDA希望该公司提交更多的数据来支持BLA的批准,并希望其在开展新的临床试验之前先解决remestemcel-L的化学、生产和质量控制(CMC)问题。
remestemcel-L是由Mesoblast开发的一款骨髓来源的同种异基因间充质干细胞疗法,通过静脉输注给药,用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)的12岁以下儿童患者。如果能够顺利获得批准,remestemcel-L将成为首个获准在美国上市的异体“现货型”细胞药物,也是首个适用于12岁以下SR-aGVHD儿童的治疗药物。该产品已于2015年9月在日本获批上市,JCR Pharmaceuticals拥有该产品在日本的开发和商业化权益。2020年4月,FDA已受理remestemcel-L的BLA,同时授予该申请优先审评资格。虽然 remestemcel-L在2020年8月获得美国FDA肿瘤药物咨询委员会(ODAC)9:1的压倒性支持,但FDA最终驳回了Mesoblast的上市文件,拒绝批准其上市。此次上市申请再次被拒,为remestemcel-L的后续开发蒙上了阴影。
此前Mesoblast重新递交了临床试验新增数据,获得了FDA认可和重新受理上市申请,数据包括:(1)对高危疾病儿童匹配性研究。对25位在Phase III中接受治疗的儿童和27位接受不同治疗的儿童进行比较。结果显示:在接受治疗28天内,接受remestemcel-L治疗的高危儿童67%产生了积极应答,存活天数超过180天,对照组中仅有10%。(2)Phase III中51位儿童患者的4年生存数据。结果显示:患者从2年预期生存率为25-38%改善为1年生存率为63%,2年生存率为51%,疗法效果积极。此次上市申请再次被拒,Mesoblast将进行一项针对死亡率更高的高危成人患者的对照试验。
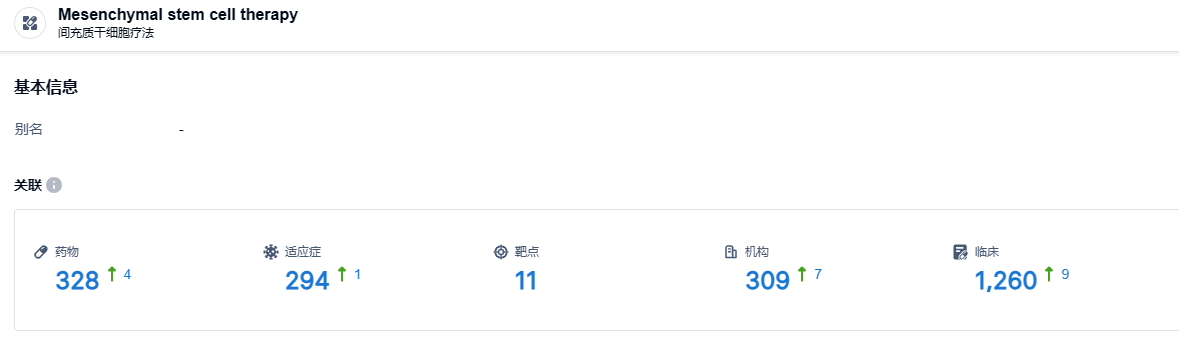
根据智慧芽新药情报库所披露的信息(点击下方卡片直达 间充质干细胞疗法 药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2023 年8月4日,间充质干细胞疗法这一药物类型共有在研药物328个,包含的适应症有294种,靶点11个,在研机构309家,涉及相关的临床试验1260件……间充质干细胞疗法在多种疾病有着不俗的潜力,期待remestemcel-L后续研发顺利。