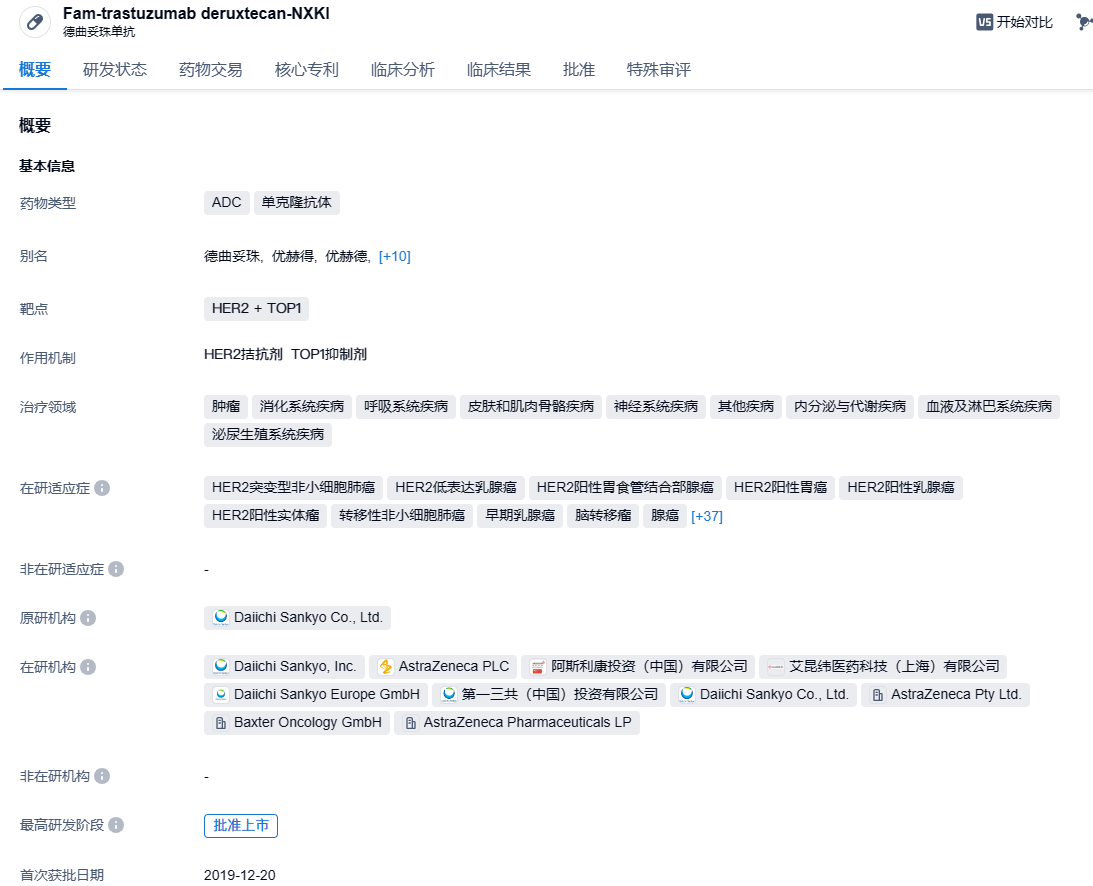
第一三共/阿斯利康靶向HER2 ADC新药Enhertu在华获批肺癌适应症
10月14日,第一三共和阿斯利康共同宣布,联合开发和商业化的优赫得®(英文商品名:Enhertu® ,通用名:注射用德曲妥珠单抗)获NMPA附条件批准,用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性NSCLC成人患者。
德曲妥珠单抗(Trastuzumab deruxtecan)(研发代号:DS-8201)是第一三共开发的一款抗体偶联药物(ADC),由抗HER2人源化单克隆抗体与载药拓扑异构酶Ⅰ抑制剂DXd(payload)通过可裂解连接子(linker)组成,其DAR值达理论最大值8,具有避免耐药、特异性强、高细胞毒性和安全性良好的特点。与HER2结合后,德曲妥珠单抗会破坏HER2信号,介导抗体依赖的细胞毒性反应,并通过内吞进入细胞内释放DXd,进而导致DNA损伤和细胞凋亡。此外,连接子与载药连接处的自切割修饰赋予的高效膜透过性,使德曲妥珠单抗能够发挥“旁观者效应”,克服瘤内异质性。本品最早由第一三共开发。2019年3月,阿斯利康与第一三共达成一项高达69亿美元的合作,在全球范围内共同开发和商业推广德曲妥珠单抗。2023年2月,注射用德曲妥珠单抗获得NMPA批准上市,单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。不到2年时间,已接连获批了单药治疗既往接受过抗HER2药物治疗的HER2阳性晚期乳腺癌患者;或既往在转移性阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的HER2低表达(IHC 1+或IHC 2+/ISH-)晚期乳腺癌患者以及单药治疗既往接受过两种或两种以上治疗方案的HER2阳性晚期胃或胃食管结合部腺癌患者。本次是该药物在国内批准上市的第四个适应症,而且是国内首个且唯一获批用于治疗HER2突变晚期NSCLC的ADC药物。
针对中国肺癌患者治疗的研究数据于2024年4月揭晓,也就是DESTINY-Lung05试验。DESTINY-Lung05 研究是一项开放性、单臂、II 期研究,旨在 DS-8201a 在接受 ≥ 1 次抗肿瘤治疗(无 HER2 定向治疗)后疾病进展、携带 HER2 19/20 号外显子突变的转移性非鳞状 NSCLC 中国患者的疗效和安全性。主要终点为经 ICR 评估确认的 ORR。次要终点包括:经研究者评估(INV)确认的 ORR、经 ICR 和 INV 评估确认的 DOR、DCR、PFS 和安全性。截至 2023 年 9 月 23 日,共有 72 名 HER2 突变 NSCLC 患者接受德曲妥珠单抗 5.4 mg/kg 治疗,中位随访时间为 9.8 个月。结果显示,经 ICR 评估确认的 ORR 达 58.3%(95%CI:46.1-69.8),其中有 1 例患者达到 CR,累计 41 例患者达到 PR。在次要研究终点中,ICR 评估确认的 DCR 为 91.7%,与 INV 的评估结果 93.1% 具有一致性。ICR 评估的中位 DOR 和中位 PFS 尚未达到研究终点,但已经显示出显著的改善趋势。INV 评估确认的中位 DOR 和中位 PFS 分别为 9.0 个月(95%CI:7.2,NE)和 10.8 个月(95%CI:7.2,NE)。安全性方面,共有 51.4% 的患者发生了 ≥ 3 级的药物相关不良事件,最常见的为中性粒细胞减少(26.4%)、血小板减少(18.1%)等。此外,药物相关性肺间质性疾病/肺炎发生率较低,仅为 9.7%。
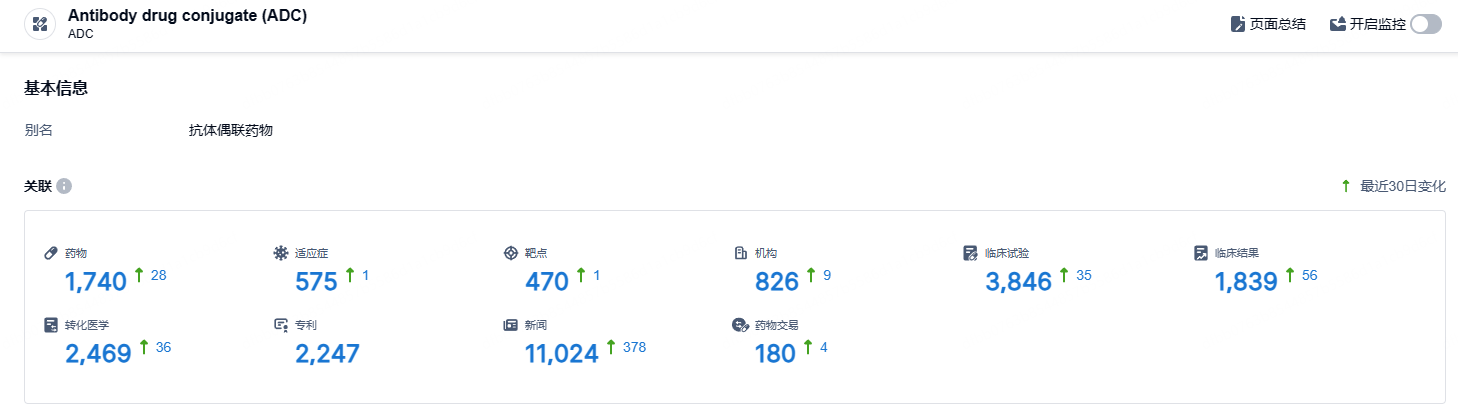
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 ADC 药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2024年10月15日,ADC这一药物类型共有在研药物1740个,包含的适应症有575种,靶点470个,在研机构826家,涉及相关的临床试验3846件……ADC药物研发已成红海之势,而HER2更是布局更多的靶点之一。期待德曲妥珠单抗的后续表现。