阿斯利康启动TIGIT/PD1双抗术后辅助治疗III期临床,治疗胆道癌
2023年10月31日,阿斯利康在ClinicalTrials.gov官网登记了一项Rilvegostomig联合化疗用于胆道癌术后辅助治疗的III期ARTEMIDE-Bil01(NCT06109779)临床研究。
Rilvegostomig(AZD2936)是一款靶向PD-1 + TIGIT 双特异性抗体,基于Compugen在研抗TIGIT抗体COM902开发而来。2018年,Compugen和阿斯利康达成了一项经修订的协议,根据该协议,Compugen向阿斯利康提供了独家许可,允许阿斯利康使用Compugen与TIGIT结合的单特异性抗体(包括COM902)开发双特异性和多特异性抗体产品;迄今为止,Compugen已收到1000万美元的预付款,额外的1550万美元的里程碑付款,并有权获得总计2亿美元的开发,监管和商业里程碑,以及未来产品销售的分级特许权使用费。与COM902一样,rilvegostomig被设计用于降低Fc效应器功能,具有增强抗肿瘤活性的潜力。2022年3月, 阿斯利康向NMPA提交AZD2936的临床试验申请获得受理。
根据2023年ASCO年会上ARTEMIDE-01研究(NCT04995523)的初步结果显示,PD-1和TIGIT双特异性抗体Rilvegostomig(AZD2936)在晚期或转移性PD-L1阳性非小细胞肺癌(NSCLC)患者中,对至少1种先前的检查点抑制剂(CPI)治疗耐药的患者显示出了可耐受性,初步疗效也展现出了一定前景。在研究中,研究人员逐渐增加了药物剂量,以寻求找到2期临床试验的推荐剂量。剂量先从70mg逐渐增加到210mg、750mg、1500mg,之后给出了推荐剂量为750mg的结论。而在推荐剂量下,患者中有4.0%的人肿瘤大幅缩小。此外,还有44%的患者病情稳定。疾病控制率在第9周和第27周分别为48.0%和12%。该药耐受良好,没有看到任何4级或5级治疗相关不良事件,也没观察到剂量限制性毒性。
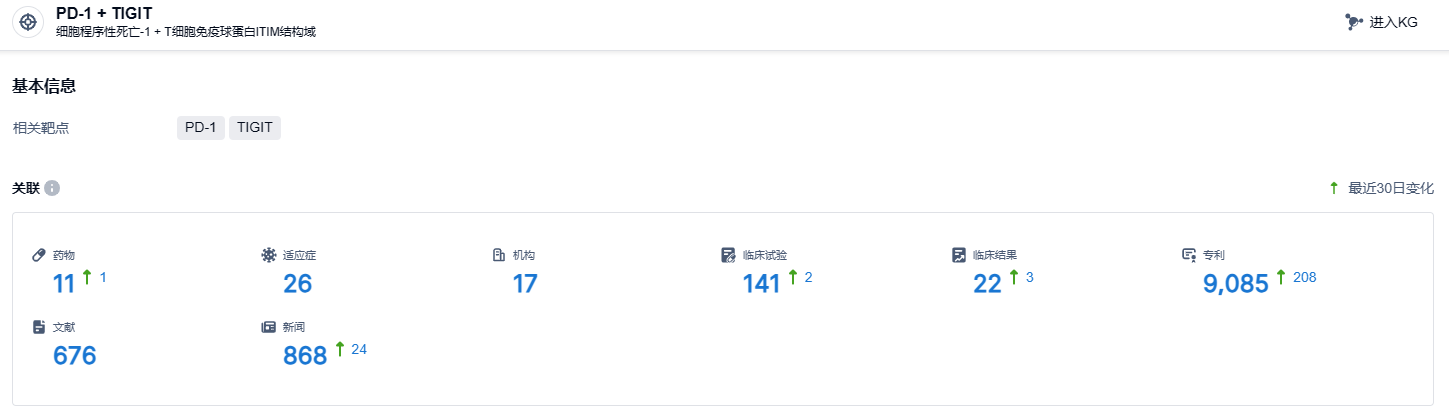
根据智慧芽新药情报库所披露的信息 (点击下方图片直达PD-1 + TIGIT 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月2日,PD-1 + TIGIT靶点共有在研药物11个,包含的适应症有26种,在研机构17家,涉及相关的临床试验141件,专利多达9085件……入组ARTEMIDE-01研究的大多数患者,都属于此前使用免疫治疗耐药的晚期肺癌患者。因此作为后续药物,Rilvegostomig的肿瘤控制率其实并不差。期待Rilvegostomig能够研发顺利。