基石药业/辉瑞舒格利单抗新适应症在国内获批,全球首个治疗R/R ENKTL
2023年10月30日,辉瑞公司宣布,PD-L1单抗舒格利单抗的第3个适应症获国家药品监督管理局(NMPA)附条件批准,单药用于治疗复发或难治性结外NK/T细胞淋巴瘤(R/R ENKTL)成人患者。作为全球首个治疗R/R ENKTL的PD-L1单抗,舒格利单抗将改变R/R ENKTL领域尚无标准治疗方法的临床困境。
舒格利单抗(商品名:择捷美®)是基石药业研发的一款抗PD-L1单抗,目前,舒格利单抗已在国内获批两项适应症:联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗(2021/12);用于同步或序贯放化疗后未发生疾病进展的不可切除的III期非小细胞肺癌(NSCLC)患者巩固治疗(2022/05)。值得一提的是,舒格利单抗已被纳入《2022版CSCO非小细胞肺癌诊疗指南》,推荐联合化疗一线治疗IV期无驱动基因非鳞/鳞状NSCLC患者,以及作为巩固治疗用于同步或序贯放化疗后III期NSCLC患者。
舒格利单抗此次适应症的获批是基于GEMSTONE-201研究,该研究旨在评估择捷美®作为单药治疗成人R/R ENKTL的有效性和安全性。研究结果显示,相较于历史对照,择捷美®显著提高了客观缓解率(ORR);在78例疗效可评估的患者中,独立影像评估委员会(IRRC)评估的ORR为44.9%,其中完全缓解率达到35.9%。研究者的客观缓解率评估结果与IRRC评估高度一致。同时,亚组分析表明择捷美®在R/R ENKTL患者中具有广泛有效性,包括接受过多线治疗的患者、并且不论前线是否达到缓解。择捷美®在R/R ENKTL患者中耐受性和安全性良好,未发现新的安全性信号。该研究的主要结果曾在2022年6月的美国临床肿瘤学会(ASCO)年会上以口头汇报形式公布,并于2023年3月在国际知名的肿瘤学权威期刊《Journal of Clinical Oncology》(JCO)全文发表。
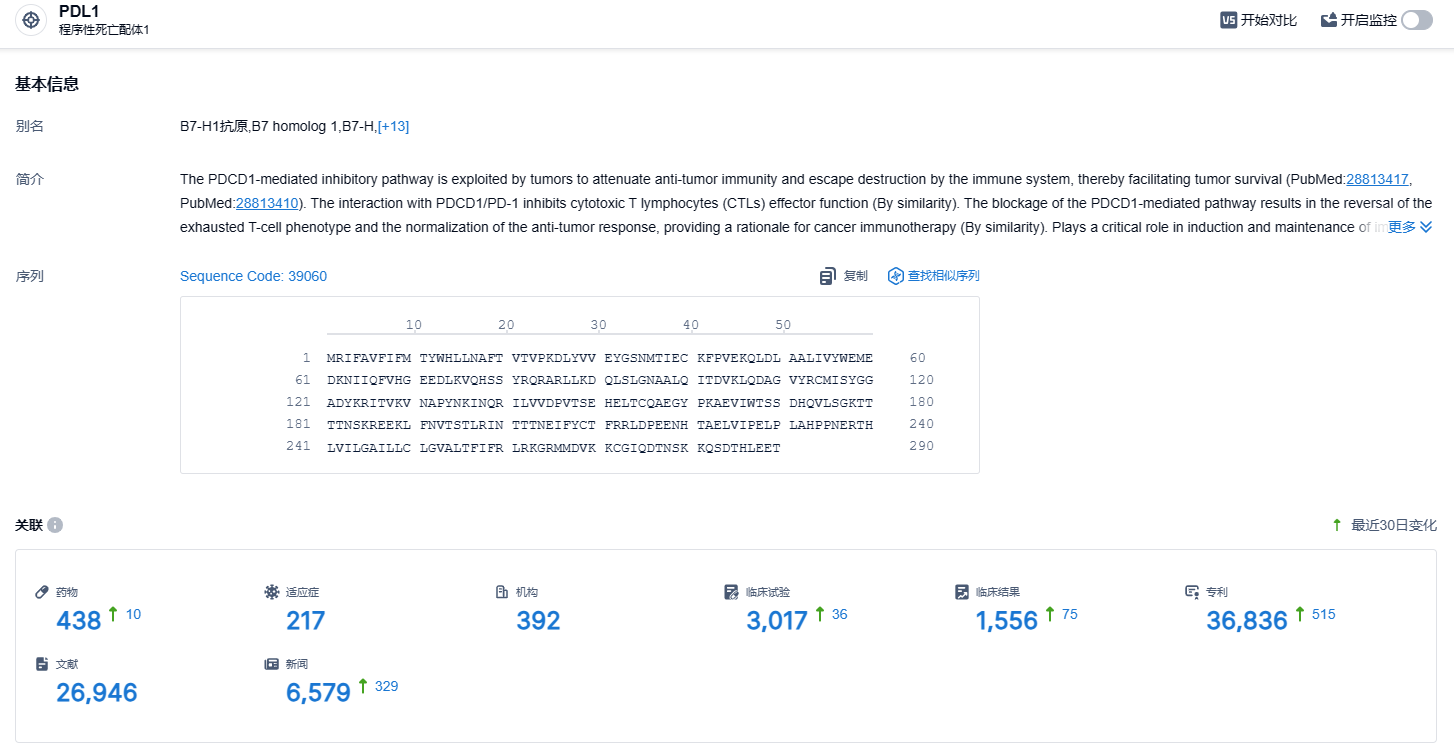
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月1日,PD-L1靶点共有在研药物438个,包含的适应症有217种,在研机构392家,涉及相关的临床试验3004件,专利多达36685件……2020年10月,基石药业将舒格利单抗和抗PD-1单抗CS1003在大中华区以外地区的开发和商业化权益授权给EQRx公司,合作涉及金额高达13亿美元。EQRx公司已先后向英国药品和医疗保健用品管理局(MHRA)和欧洲药品管理局(EMA)递交舒格利单抗联合化疗一线治疗转移性NSCLC的上市许可申请,期待舒格利单抗在国际市场能够成功上市。