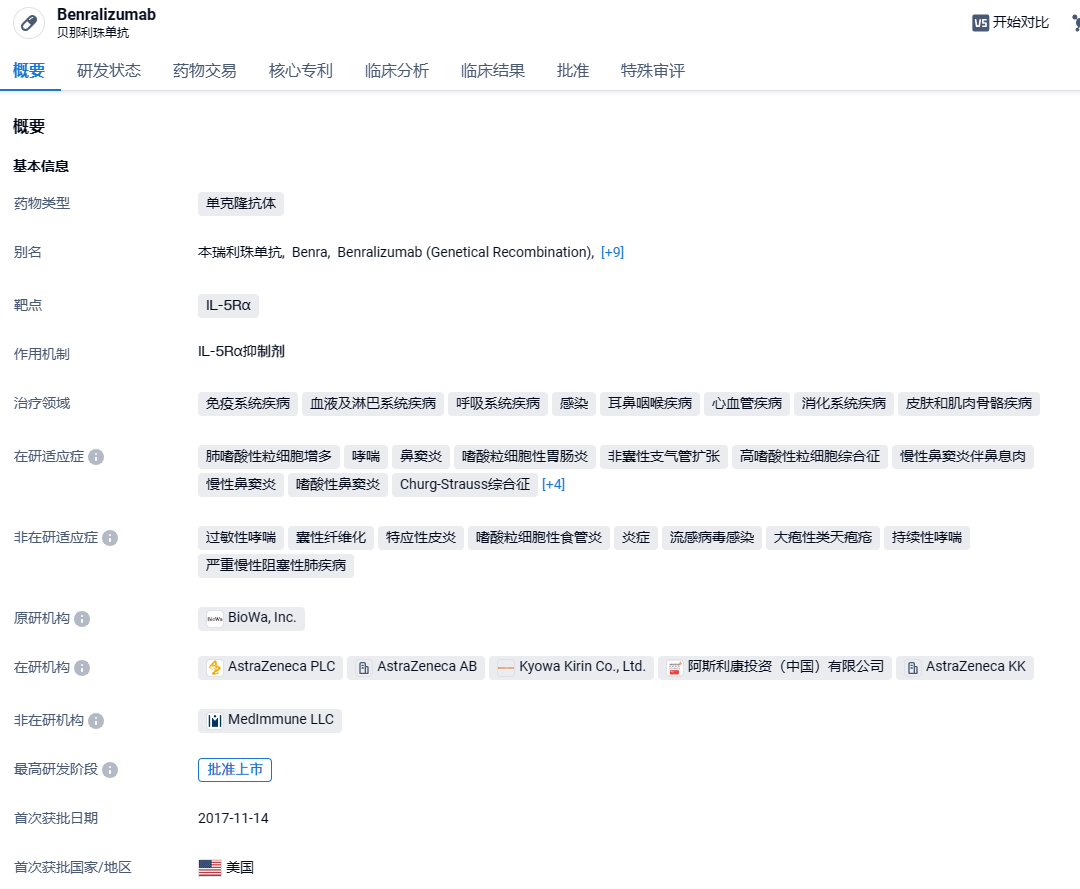
阿斯利康IL-5Rα单抗benralizumab 3期试验登上NEJM,针对嗜酸性肉芽肿性多血管炎
近日,《新英格兰医学杂志》发表了阿斯利康(AstraZeneca)的IL-5受体α(IL-5Rα)抑制剂Fasenra(benralizumab)用于治疗复发或难治性嗜酸性肉芽肿性多血管炎(EGPA)患者3期试验MANDARA的积极结果。
benralizumab是最初由协和麒麟开发的一种人源化的抗IL-5Rα单克隆抗体,具有抗嗜酸性粒细胞活性。缺乏聚焦(afocusylation)增加了其对CD16a的亲和力,并显著增强了NK细胞介导的抗体依赖性细胞介导的细胞毒性(ADCC)。2006年12月,MedImmune与协和麒麟达成协议,获得benralizumab在美国、欧洲和其它国家的商业化权益。2007年4月,阿斯利康以156亿美元收购MedImmune,将其管线中的45款在研产品收入囊中。2016年10月,阿斯利康扩大benralizumab的商业化权益至日本。2019年3月,阿斯利康与协和麒麟达成新的许可协议,获得benralizumab在亚洲地区的开发和商业化权益以及全球商业化权益。2023年12月26日,据CDE官网,阿斯利康Benralizumab注射液获批临床,拟用于≥12岁的青少年及成人嗜酸粒细胞性重度哮喘患者的维持药物的减药治疗。
2017年11月,benralizumab首次在美国获批上市,商品名为Fasenra,用于12岁及以上的重症嗜酸性粒细胞性哮喘患者的附加维持治疗。嗜酸性粒细胞性哮喘是哮喘的一种亚型,人类认识它已经超过100年,它通常成年发病,且往往症状严重,难以控制,甚至对高剂量激素也反应不佳。嗜酸性哮喘影响整个呼吸道,从鼻窦到远端气道。嗜酸性粒细胞性哮喘患者经常合并鼻息肉和慢性鼻窦炎。2019年10月,FDA批准了患者可自行注射的预填充一次性自动注射笔(FASENRA Pen™)。
MANDARA试验比较benralizumab与IL-5单抗Nucala(mepolizumab)用于治疗使用口服皮质类固醇(OCS)EGPA患者的疗效,这些患者同时或没有进行稳定的免疫抑制治疗。患者被随机分配接受单次30 mg皮下注射benralizumab,或皮下注射300 mg活性对照组药物。结果显示,试验达成主要终点,benralizumab在治疗EGPA患者上与活性对照组达非劣效性。在第36周和第48周,benralizumab组患者在主要终点调整缓解率为59%,而活性对照组为56%(比率差异:3%;95% CI:–13,18)。
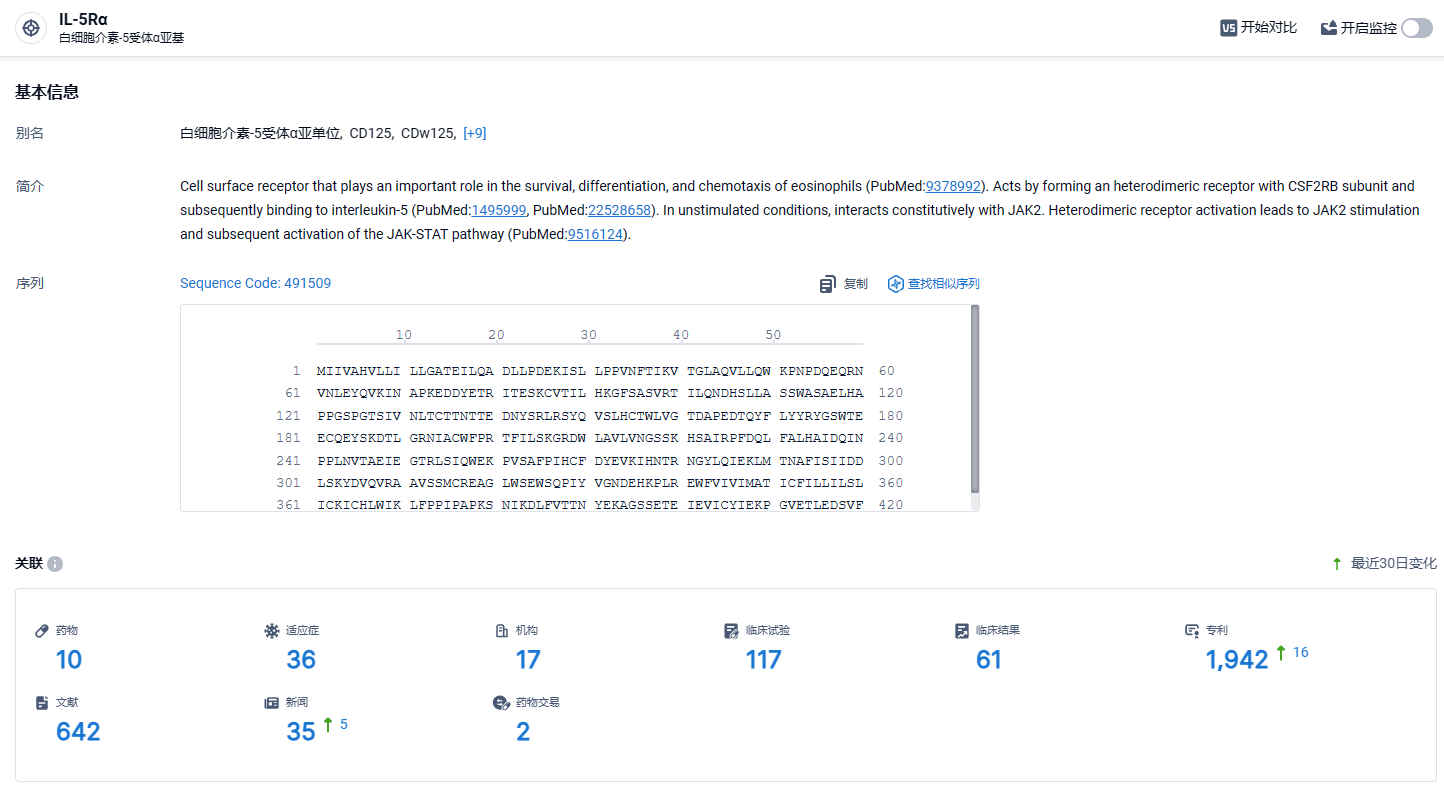
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-5Rα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年2月27日,IL-5Rα靶点共有在研药物10个,包含的适应症有36种,在研机构17家,涉及相关的临床试验117件,专利多达1942件……期待这款IL-5Rα单抗能够早日在国内上市,给国内患者带来新的治疗选择。