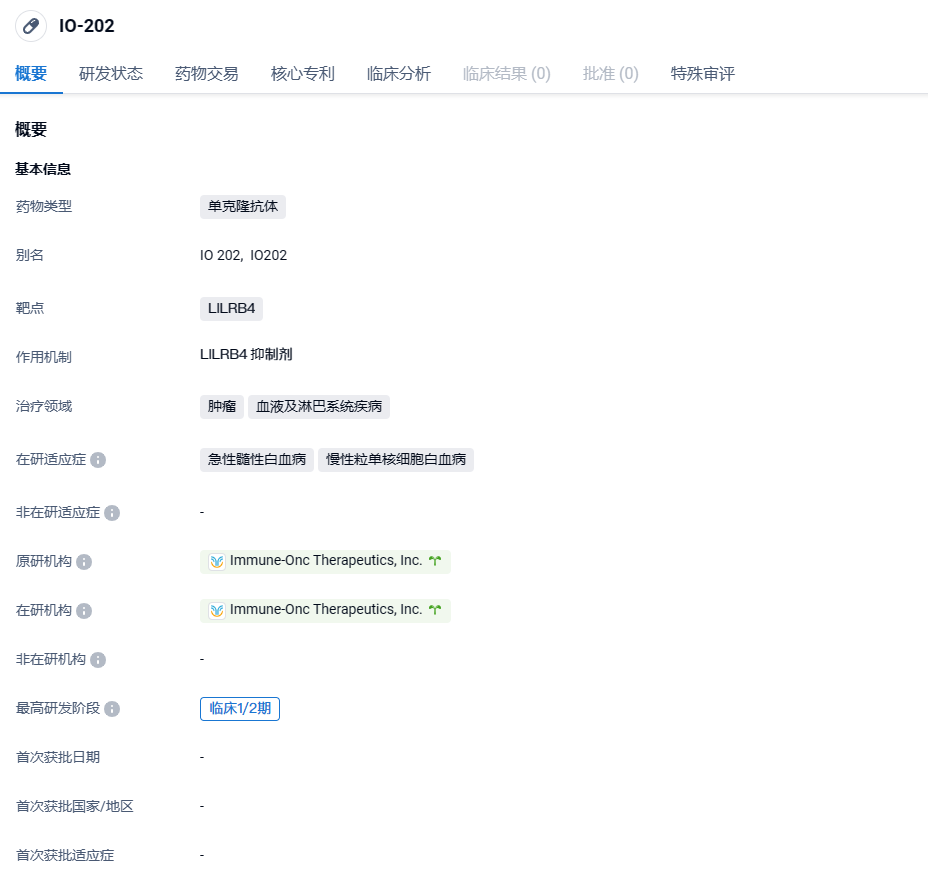
以明生物抗LILRB4抗体IO-202获FDA孤儿药资格,针对性粒单核细胞白血病
2024年2月22日,以明生物(Immune-Onc Therapeutics)宣布,美国FDA授予IO-202治疗慢性粒单核细胞白血病(CMML)适应症的孤儿药资格。FDA此前已经授予IO-202治疗复发或难治性CMML的快速通道资格。
IO-202是全球首创靶向LILRB4的抑制性抗体,在血液瘤和实体瘤的免疫治疗方面具有广泛潜力。血液瘤的临床前研究表明,IO-202可激活T细胞杀伤作用将“别杀我”信号转换为“来杀我”信号,并通过抑制血液瘤细胞浸润将“看不到我”信号转换为“我在这里”信号。实体瘤的临床前数据表明,IO-202在体外研究中具有增强树突状细胞功能和T细胞激活作用,并能在实体瘤体内研究模型中抑制肿瘤生长。
目前,IO-202正处于针对急性髓系白血病(AML)和慢性粒-单核细胞白血病(CMML)适应症的I期临床开发阶段。2020年10月,IO-202获得美国FDA授予的孤儿药资格认定 ,用于治疗急性髓系白血病。 2022年1月,IO-202实体瘤临床研究IND在美国获批 。
2023年6月,以明生物(Immune-Onc Therapeutics)宣布了其潜在“first-in-class”抗体疗法IO-202的1期临床试验积极结果。这是一项1期多中心、开放标签、剂量递增研究,主要评估R/R CMML和R/R AML患者队列接受IO-202治疗的安全性和耐受性。次要和探索性终点包括药代动力学、免疫原性、药效学、生物标志物效应,以及IO-202作为单药疗法和与阿扎胞苷联用的临床缓解率。
IO-202治疗耐受性良好。研究没有观察到剂量限制性毒性,也没有达到最大耐受剂量。在单药治疗队列中,一例CMML患者出现临床获益超过一年,一例AML患者实现部分缓解(PR)。在联合治疗队列中,一例LILRB4高表达的 AML 患者获得完全缓解(CR)超10 个月,现仍持续。此外,五例CMML患者中有三例获得临床效益,包括骨髓完全缓解。基于该试验剂量递增部分的积极结果,采用生物标志物带动的患者筛选策略,公司已开始剂量扩展队列的入组工作,招募LILRB4高表达的单核细胞分化型AML患者以及CMML患者。
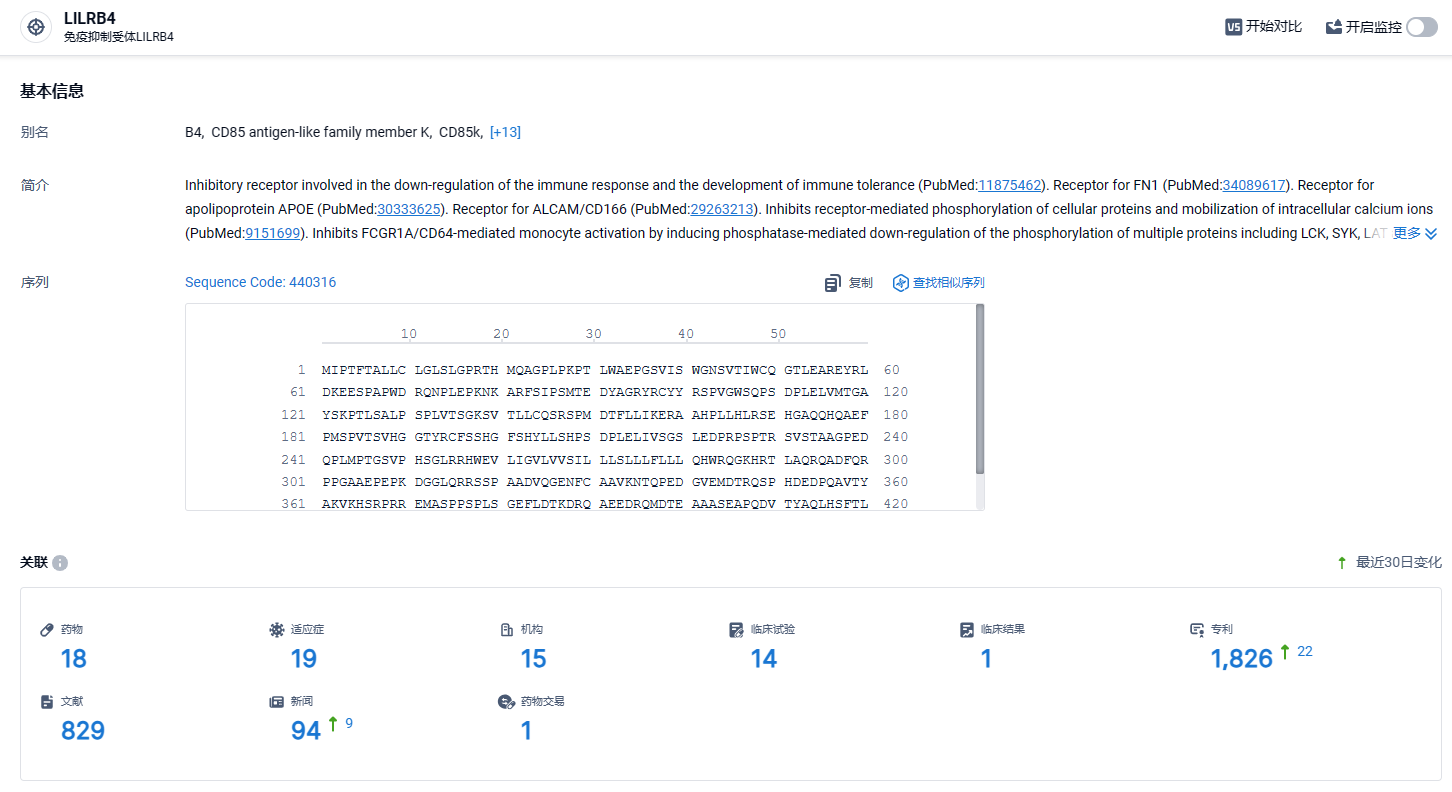
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 LILRB4 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年2月24日,LILRB4 靶点共有在研药物18个,包含的适应症有28种,在研机构14家,涉及相关的临床试验11件,专利多达1602件……CMML是一种罕见的血液系统肿瘤,在美国的年发病率为百万分之四,即每年约1,100 例。CMML的特征是单核细胞增多(外周血单核细胞>1x10e9/L,单核细胞占白细胞计数≥10%),并伴有骨髓增生异常。IO-202有望为该类疾病患者带来新的治疗选择。