E3连接酶PROTACs擂台:KEAP1 vs. CRBN,哪方胜?
蛋白降解靶向嵌合体小分子药物免疫疗法抗体
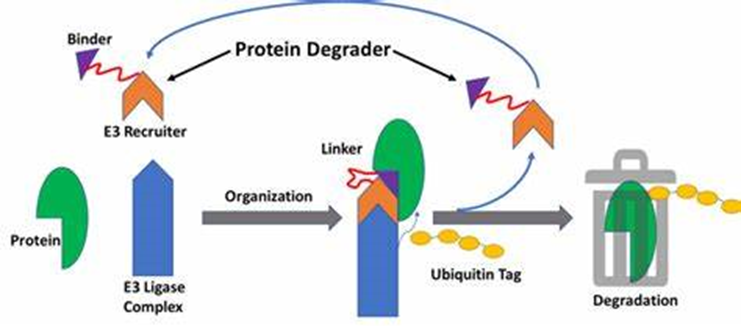
靶蛋白降解(TPD)在基础研究和转化研究中具有重要地位,其通过小分子降解剂(degraders)募集泛素E3连接酶,使目标蛋白泛素化,进而被蛋白酶体降解。与传统抑制剂相比,TPD具有如下优势:(1)降解目标蛋白;(2)挑战“不可成药”靶点;(3)增大选择空间;(4)克服耐药性。此外,降解剂作为蛋白敲除剂与基因敲除/敲低技术形成绝佳互补。蛋白酶水解靶向嵌合体(PROTACs)是TPD领域最常见的技术之一,同TPD一样,极具应用前景并受到广泛关注。
Preview
来源: 药时代
图1 TPD
01 PROTACs
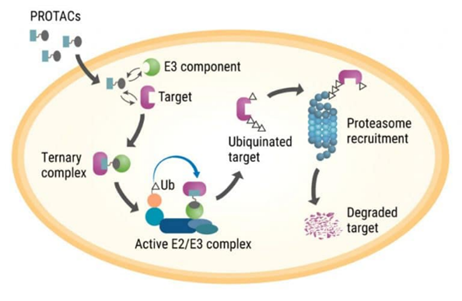
PROTACs由负责与目标蛋白结合的配基和负责募集E3连接酶的配基构成,二者通过linker相连。PROTACs可降解多种目标蛋白,包括激酶、转录因子以及病毒蛋白。已知的超过600种泛素E3连接酶中,目前应用的仅有几种。有限的选择缩小了可用范围,因为不是每种目标蛋白与E3连接酶的结合都可以形成具有活性的泛素化复合体。因此,E3连接酶配体的筛选是PROTACs技术发展的关键。目前应用最广泛的E3连接酶当属CRBN和VHL,然而近期出现了CRBN-PROTACs或VHL-PROTACs抗药性报道,因此新E3连接酶配体的筛选迫在眉睫。新E3连接酶的开发可以增加靶点选择性,同时组织或细胞特异性E3连接酶的开发也会为疾病的治疗增添筹码。
Preview
来源: 药时代
图2 PROTAC
02
CRBN
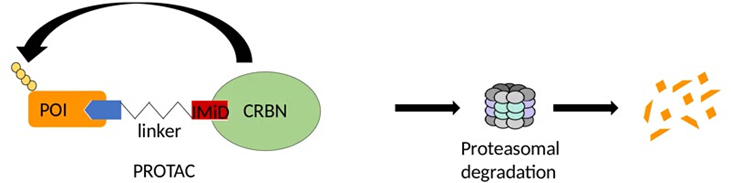
20世纪50年代,沙利度胺的使用造成很多儿童畸形。20世纪60年代该药退市。接下来的几十年里,沙利度胺被广泛研究,而后被重新开发作为免疫调节剂用于多发性骨髓瘤等治疗。然而,直到2010年沙利度胺的作用机制才被发现,并被证明与CRBN有关。2015年,基于JQ1(靶向BRD4)和沙利度胺衍生物(募集CRBN)首次构建出2款PROTACs——ARV-825和dBET1。这2款PROTACs都可有效诱导BRD4降解,进而抑制细胞增殖。但因dBET1表现出良好的体内、体外抗急性髓性白血病活性,而被作为首款可在体内应用的PROTAC进行了广泛报道。而后研究人员对各种沙利度胺衍生物进行了探索,用于提高PROTAC技术效率。
Preview
来源: 药时代
图3 CRBN-PROTACs
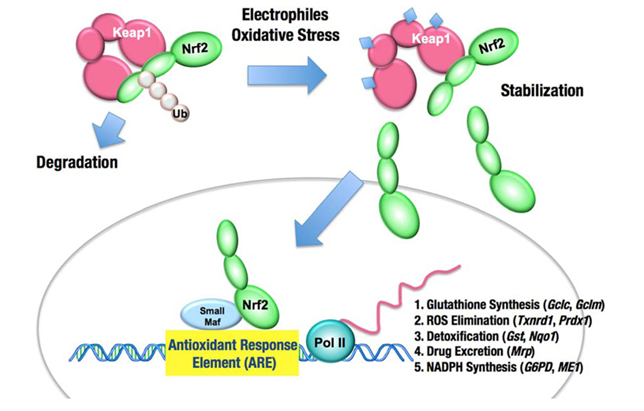
03 KEAP1
Preview
来源: 药时代
图4 KEAP1-NRF2通路
04 KEAP1-PROTACs
基于这些抑制剂,开发出很多KEAP1-PROTACs。早期研究在tau和BRD4中证明了KEAP1的作用。Du等以KI-696作为KEAP1配基,探索了KEAP1应用范围。研究在转录和表观遗传调控因子(BRD4/ BRD9),激酶(局灶粘附激酶[FAK]), Bruton酪氨酸激酶(BTK), EGFR和CDK4/6中进行。结果证明KEAP1-PROTACs仅可降解BRD4和FAK,BRD9、BTK、EGFR和CDK4/6这些可被CRBN-PROTACs或VHL-PROTACs降解的目标蛋白无法被KEAP1-PROTACs降解。Du等还设计了一款由KEAP1配基和CRBN配基相结合的PROTAC,最终KEAP1蛋白被CRBN泛素化并被蛋白酶体降解。
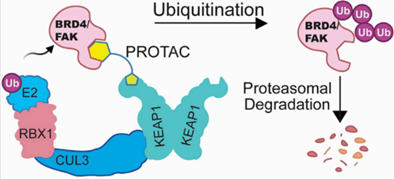
Preview
来源: 药时代
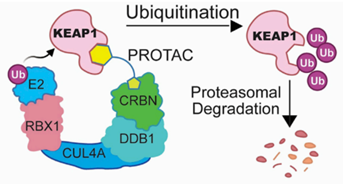
Preview
来源: 药时代
图6 KEAP1被CRBN泛素化
结语
蛋白质是构成细胞的主要成分,承担着维持细胞生存的重要功能。人类细胞中大约有20,000多种蛋白,它们的平衡对细胞的健康至关重要。一种蛋白的失衡足以使细胞致病,寻找用于调节蛋白失衡的小分子即成为药物开发的首要环节。“可成药”靶点非常有限,历史上科学家一直将目光聚焦于这些“可成药”靶点上。然而,维持细胞稳态的蛋白有很多,靶向“不可成药”蛋白或许才是更多疾病治疗的关键。PROTACs技术的出现将原来的“不可能”变为“有可能”,尽管研发路上困难重重,但却给疑难病症的治愈带来了一丝曙光。
参考文献:1.Lee J, Lee Y, Jung YM, Park JH, Yoo HS, Park
J. Discovery of E3 Ligase Ligands for Target Protein Degradation. Molecules
(Basel, Switzerland). 2022;27(19).2.Du G, Jiang J, Henning NJ, et al. Exploring
the target scope of KEAP1 E3 ligase-based PROTACs. Cell chemical biology.
2022;29(10):1470-1481.e1431.
内容来源于网络,如有侵权,请联系删除。
机构
-来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


