《胃肠病学》:中国科学家破解肝癌对仑伐替尼耐药之谜,并发现肝癌治疗新靶点!
2023-03-13
CSCO会议临床研究
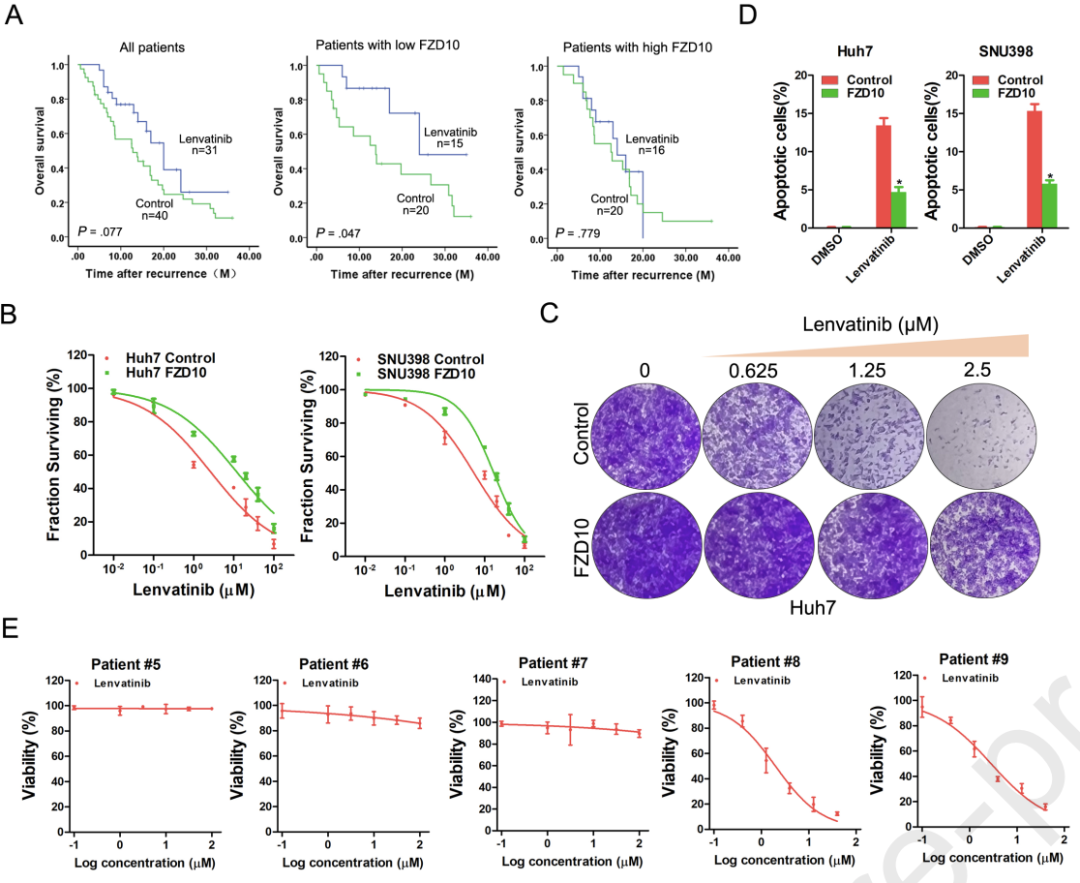
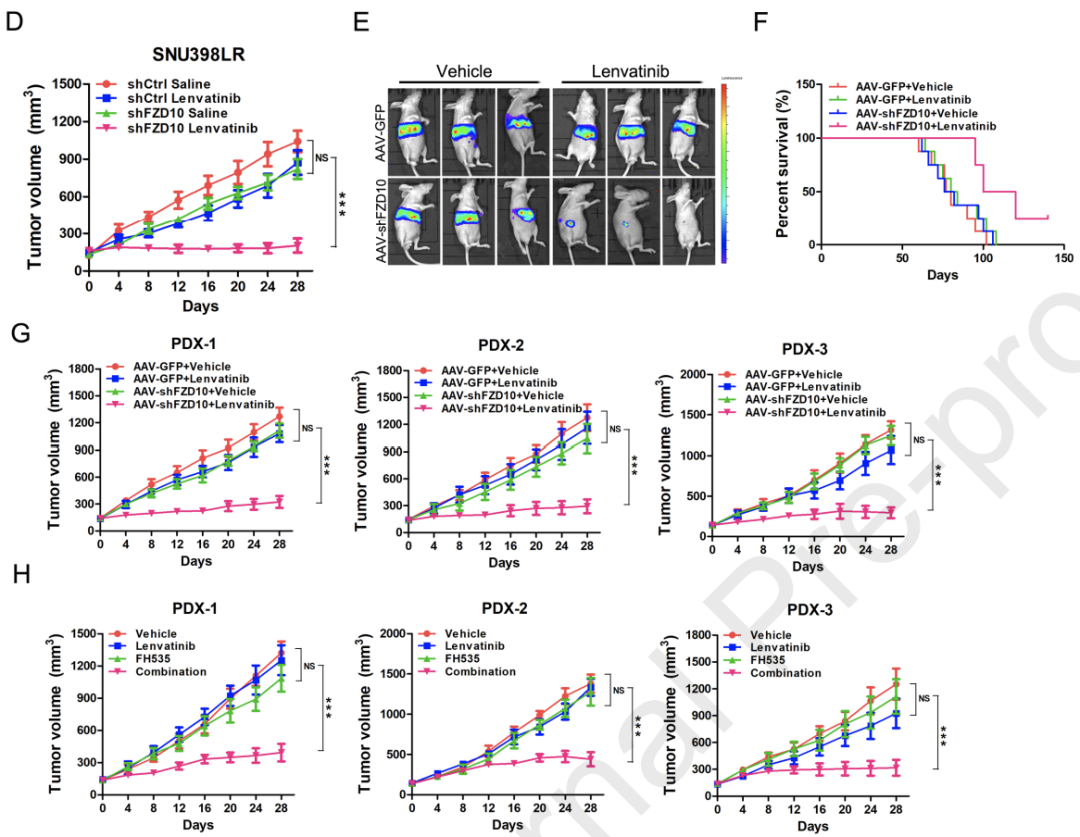
总体而言,耐药是目前HCC相关死亡的主要原因之一,但对其背后的机制仍知之甚少。
近日,同济大学医学院附属东方医院、海军军医大学第三附属医院和上海长海医院的研究人员,在胃肠疾病领域权威期刊Gastroenterology发表了最新研究成果[2]。

Preview
来源: 生物谷
论文首页截图
Preview
来源: 生物谷
Preview
来源: 生物谷
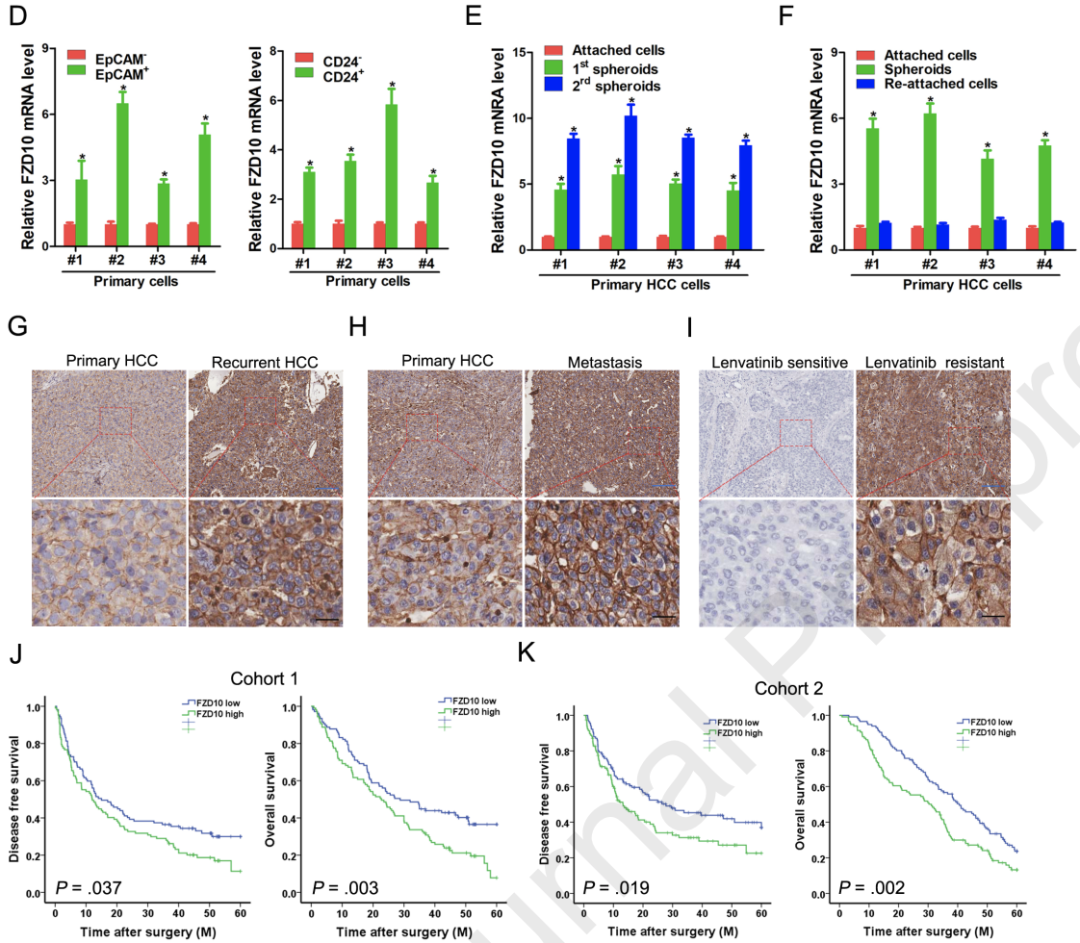
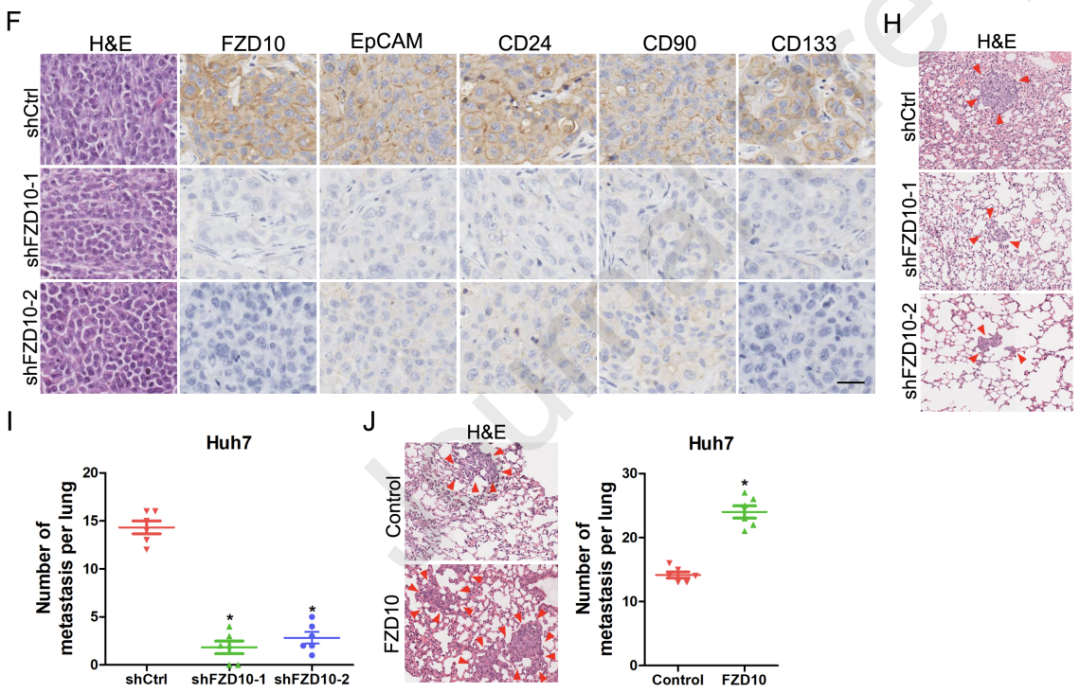
FZD10促进肝脏CSCs的扩增
为了阐明FZD10促进肝脏CSCs扩增的机制,研究人员使用RNA测序分析了FZD10过表达的HCC细胞中的基因表达情况。
Preview
来源: 生物谷
Preview
来源: 生物谷
Preview
来源: 生物谷
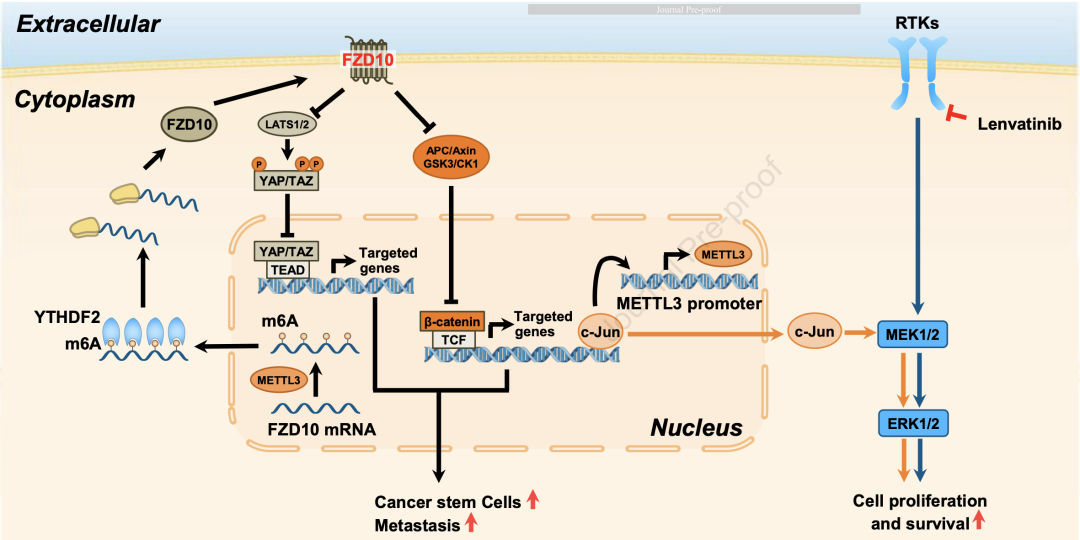
机制示意图
参考文献:
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021. CA Cancer J Clin 2021;71:7-33.
[2] Wang J, Yu H, Dong W, Zhang C, Hu M, Ma W, Jiang X, Li H, Yang P, Xiang D. M6A-mediated upregulation of FZD10 regulates liver cancer stem cells properties and lenvatinib resistance through WNT/β-catenin and Hippo signaling pathways. Gastroenterology. 2023 Feb 8:S0016-5085(23)00114-2.
[3] Han T, Zhang Y, Yang X, et al. miR-552 Regulates Liver Tumor-Initiating Cell Expansion and Sorafenib Resistance. Mol Ther Nucleic Acids 2020;19:1073-1085.
[4] Jin H, Shi Y, Lv Y, et al. EGFR activation limits the response of liver cancer to lenvatinib. Nature 2021.
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
机构
-热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


