预约演示
更新于:2025-05-07
Sarcoidosis
结节病
更新于:2025-05-07
基本信息
别名 BESNIER-BOECK-SCHAUMANN DISEASE、BOECK SARCOID、Benign Lymphogranulomatosis + [106] |
简介 An idiopathic systemic inflammatory granulomatous disorder comprised of epithelioid and multinucleated giant cells with little necrosis. It usually invades the lungs with fibrosis and may also involve lymph nodes, skin, liver, spleen, eyes, phalangeal bones, and parotid glands. |
关联
47
项与 结节病 相关的药物靶点 |
作用机制 TYK2抑制剂 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2022-09-09 |
靶点 |
作用机制 JAK1抑制剂 |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 英国 |
首次获批日期2021-09-08 |
作用机制 VIPR1激动剂 [+1] |
最高研发阶段批准上市 |
首次获批国家/地区 格鲁吉亚 |
首次获批日期2021-07-27 |
434
项与 结节病 相关的临床试验NCT05910554
Investigation of the Efficacy of Metformin Therapy on Pulmonary Sarcoidosis Phase II Randomized, Double-blind, Placebo-controlled Trial
This is a double blinded, randomized, placebo controlled clinical trial of 40 participants with pulmonary sarcoidosis.
Primary Objective: To assess the steroid-sparing efficacy and safety of oral metformin therapy in participants with confirmed progressive pulmonary sarcoidosis for participants with steroid dependent disease.
Primary Objective: To assess the steroid-sparing efficacy and safety of oral metformin therapy in participants with confirmed progressive pulmonary sarcoidosis for participants with steroid dependent disease.
开始日期2025-12-10 |
NCT06868381
A Phase IIa, Single-Site, Open-Label Trial of Baricitinib in Patients With Cardiac Sarcoidosis
The goal of this clinical trial is to learn if baricitinib in combination with a background steroid-sparing medication can treat active cardiac sarcoidosis in adults. The main question it aims to answer is:
- In patients with active cardiac sarcoidosis, does treatment with baricitinib improve cardiac sarcoidosis disease activity as assessed by changes on cardiac FDG-PET/CT?
Participants will:
* Take baricitinib in combination with a steroid-sparing therapy for up to 16 weeks
* Visit the clinic every two to four weeks for checkups and tests
* Be asked to complete questionnaires to see how they feel on baricitinib and medication diaries to record when they take baricitinib
- In patients with active cardiac sarcoidosis, does treatment with baricitinib improve cardiac sarcoidosis disease activity as assessed by changes on cardiac FDG-PET/CT?
Participants will:
* Take baricitinib in combination with a steroid-sparing therapy for up to 16 weeks
* Visit the clinic every two to four weeks for checkups and tests
* Be asked to complete questionnaires to see how they feel on baricitinib and medication diaries to record when they take baricitinib
开始日期2025-05-12 |
申办/合作机构  Stanford University Stanford University [+1] |
NCT05819385
Ambispective, Non-Interventional Study to Evaluate the Epidemiology of Interstitial Lung Diseases (ILDs) Associated to Rheumatic Diseases (Rheumatoid Arthritis, Connective Tissue Diseases, Spondylarthritis and Sarcoidosis) and the Progression Risk Factors in the Mexican Population
This study aims to characterize the epidemiology of interstitial lung diseases (ILD) associated to connective tissue disease (CTD) in Mexico, and to study its correlation with the different comorbidities and treatments used, as well as the possible impacts of these factors on the outcome of progression, exacerbations, and mortality in patients with ILD associated to CTD.
开始日期2025-04-21 |
申办/合作机构 |
100 项与 结节病 相关的临床结果
登录后查看更多信息
100 项与 结节病 相关的转化医学
登录后查看更多信息
0 项与 结节病 相关的专利(医药)
登录后查看更多信息
33,012
项与 结节病 相关的文献(医药)2025-12-31·Pulmonology
Predictive role of natural killer cells in bronchoalveolar lavage fluid of patients with sarcoidosis
Article
作者: Bergantini, L. ; d'Alessandro, M. ; spalletti, M. ; Prasse, A. ; Bargagli, E. ; Masotto, E. ; Cameli, P. ; genovese, M.
2025-12-31·Pulmonology
Complete response to mTOR inhibitor following JAKi failure in severe pulmonary sarcoidosis: Authors’ reply
Article
作者: Besnard, Valérie ; Jeny*, Florence ; Kort, Fatma ; Hindré, Raphaël ; Valeyre*, Dominique ; Nunes, Hilario
2025-12-31·Pulmonology
Ultrathin bronchoscopy-guided small airway biopsy for diagnosing sarcoidosis: A prospective study
Article
作者: Cancellieri, Alessandra ; Trisolini, Rocco ; Flore, Maria Chiara ; Zhang, QuianQuian ; Magnini, Daniele ; Pasciuto, Giuliana ; Livi, Vanina ; Richeldi, Luca ; Sotgiu, Giovanni ; Viscuso, Marta ; Leoncini, Fausto ; Puci, Mariangela
472
项与 结节病 相关的新闻(医药)2025-04-29
·抗体圈
这篇文章于2022年发表在ImmuneNetw.,主要总结了自身免疫性疾病靶向免疫治疗最新进展。摘要: 在过去的几十年里,靶向炎性细胞因子、免疫细胞和细胞内激酶的生物药物和小分子抑制剂已成为治疗自身免疫性疾病的标准护理。抑制TNF、IL-6、IL-17和IL-23彻底改变了类风湿性关节炎、强直性脊柱炎和银屑病等自身免疫性疾病的治疗。使用抗CD20mAb的B细胞耗竭疗法在神经炎症性疾病患者中显示出有希望的结果,抑制B细胞存活因子被批准用于治疗系统性红斑狼疮。靶向Ag呈递细胞和T细胞上表达的共刺激分子也有望通过调节T细胞功能在自身免疫性疾病中具有治疗潜力。 最近,靶向JAK家族(负责多个受体信号转导)的小分子激酶抑制剂在自身免疫和血液疾病领域引起了极大的兴趣。然而,在治疗效果和安全性方面仍存在未满足的医疗需求。新兴疗法旨在使用先进的分子工程技术在不影响免疫功能的情况下诱导免疫耐受。【NO.1】背景介绍 自身免疫性疾病是以自身抗原炎症失调为特征的病理性疾病,影响3%-10%的普通人群。自身免疫性疾病的常规治疗方法抑制了一般免疫功能以调节不受控制的炎症。然而,这些治疗方法在异质性患者群体中并未完全成功,其疗效以牺牲副作用为代价,特别是感染风险增加,通常来自非选择性免疫抑制。为了克服传统疗法的局限性,目前的治疗方法旨在更选择性地抑制炎症信号,同时最大限度地减少对稳态免疫功能的破坏。 最近在了解疾病发病机制和新药制造技术方面取得的进展导致靶向免疫疗法广泛用于治疗自身免疫性疾病。此外,先进的分子工程技术催生了靶向可溶性介质或细胞表面标志物的重组蛋白治疗药物,如mAb和receptor-Ab融合蛋白。自1990年代首次批准靶向TNF的选择性蛋白质疗法用于类风湿性关节炎(RA)以来,靶向免疫疗法已成为治疗自身免疫性疾病的游戏规则改变者。根据全球药品市场报告,阿达木单抗多年来一直是全球最畅销的药物,其次是其他靶向免疫疗法,如pembrolizumab、ibrutinib和ustekinumab。 随着对疾病发病机制的了解迅速增加,许多靶向炎症信号通路的生物药物正在开发中,以治疗顽固性炎症性疾病。在成功引入生物疗法治疗自身免疫性疾病后,分子靶点已扩展到细胞内激酶。小分子激酶抑制剂阻断收敛信号在治疗效果和长期安全性方面具有重要意义。 本文总结了目前针对自身免疫性疾病发病机制中涉及的信号通路的治疗方法,并介绍了旨在诱导免疫耐受的新兴免疫疗法。由于靶向免疫疗法市场正在迅速增长,因此我们专注于已获得临床批准用于治疗自身免疫性疾病的药物。【NO.2】自身免疫性疾病中的炎症 炎症是生物体修复组织损伤并防止外来物质侵害的自然过程。然而,针对自身抗原的免疫反应失调会导致免疫耐受丧失和自身免疫性疾病的发展。自身免疫源于耐受性检查点的中枢和外周缺陷以及不耐受免疫细胞的激活。自身抗原可通过从免疫特权位点释放自身抗原、产生新自身抗原以及自身蛋白与外来物质的分子模拟来诱导。 自身免疫的临床表现多种多样,从存在自身抗体的无症状疾病到导致危及生命的器官损伤的暴发性自身免疫性疾病。自身免疫性疾病的发展可由遗传易感个体的环境因素触发。环境触发因素,包括压力、吸烟和感染,会诱导先天免疫的促炎功能,并促进适应性免疫的病理反应。 尽管自身免疫的传统概念是适应性免疫系统的失调,但越来越多的证据表明,先天免疫系统对自身免疫性疾病的发生和发展也至关重要。作为先天免疫的关键参与者,巨噬细胞和树突状细胞(DC)对于抗原呈递和促炎细胞因子(如TNF、IL-1β、IL-6、IL-23、B细胞激活因子(BAFF,也称为Blys或TNFSF13B)和增殖诱导配体(APRIL,也称为TNFSF13A)的产生至关重要。1型IFN与系统性红斑狼疮(SLE)及其相关疾病的发病机制密切相关,主要由浆细胞样DC(pDC)产生,浆细胞样DC是DC的一个特殊亚群。巨噬细胞/DC和T细胞/B细胞之间的相互作用进一步促进了自身免疫性炎症。 初始CD4+Th细胞根据细胞因子环境分化为不同的T细胞亚群。T细胞通过自身抗原识别、细胞因子产生和增强的细胞毒性,在自身免疫性疾病的发病机制中发挥关键作用。近几十年来,产生IL-17和FOXP3+Tregs的Th17细胞已被强调为自身免疫性疾病的治疗靶点。 自身反应性B细胞是适应性免疫的另一个主要组分,它产生病理性自身抗体,并通过Ag呈递和细胞因子产生激活T细胞。自身抗体的产生是各种自身免疫性疾病(包括RA和SLE)的标志。RA中的抗瓜氨酸肽抗体和SLE中的抗dsDNA抗体是导致临床表现和疾病活动度的代表性致病性自身抗体。由于B细胞在自身免疫中的重要作用,B细胞表面分子是各种自身免疫性疾病的治疗靶点。 来自活化免疫细胞的可溶性介质通过与它们的同源受体结合来转导炎症信号。一旦被炎性细胞因子结合,受体就会激活JAK家族,以诱导STAT的磷酸化、二聚化和核转位。STAT的基因转录促进细胞增殖和分化以及多种炎症介质的产生,进一步加剧自身免疫性炎症。 尽管每种自身免疫性疾病的病理生理机制不同,但几种常见的炎症途径可能是免疫治疗的治疗靶点。基于我们目前对自身免疫性炎症发病机制的理解,治疗自身免疫性疾病的关键治疗靶点如图1所示。表1、2、3列出了已批准用于自身免疫性疾病或正在临床开发的靶向免疫疗法,具体如下。本文重点介绍靶向免疫治疗在免疫介导的炎症性疾病领域的临床应用。图1.自身免疫性疾病发病机制中的关键治疗靶点表1.用于治疗自身免疫性疾病的细胞因子靶向疗法靶细胞因子结构药物临床应用正在调查中(IIb或III期)TNF-ɑsTNFR2-IgG1Fc依那西普RA、pJIA、AS、银屑病、PsA抗TNF单克隆抗体英夫利昔单抗RA、AS、银屑病、PsA、UC、CD超说明书使用:BD、结节病阿达木单抗RA、pJIA、AS、银屑病、PsA、UC、CD、化脓性毛突炎、葡萄膜炎超说明书使用:BD戈利木单抗RA、AS、PsA、UC赛妥珠单抗RA、AS、银屑病、PsA、CDIL-1IL-1R拮抗剂阿那白滞素RA、大写字母川崎病(NCT04656184)超说明书使用:AOSD、sJIA、痛风、复发性心包炎等IL-1R1-IgGFc利洛西普CAPS、DIRA、复发性心包炎超说明书使用:AOSD、痛风等IL-1β抗体抗卡纳单抗AOSD、sJIA、CAPS、TRAPS、HIDS/MKD、FMFCOVID19相关CRS(12)超说明书使用:痛风和许多其他IL-6(英语)IL-6单克隆抗体抗体西鲁尤单抗RA(13,14)*奥洛珠单抗RA(15)(NCT02760407,NCT02760433,NCT03120949)克拉扎奇珠单抗RA(NCT02015520)PsA(16)COVID19相关CRS(NCT04343989)西妥昔单抗CAR-T相关CRS(NCT04975555)IL-6R抗体抗体托珠单抗RA、sJIA、pJIA、SSc相关ILD、巨细胞动脉炎、CRSPMR(NCT02908217)超说明书使用:AOSD、Takayasu动脉炎NMOSD(17)COVID19肺炎(18,19)(NCT04409262)沙利尤单抗RA类COVID19相关CRS(20)(NCT04315298)沃巴利珠单抗RA(NCT02518620)IL-17(英语)IL-17单克隆抗体抗体依奇珠单抗银屑病、PsA、轴向SpA苏金单抗AS、银屑病、PsA系统性红斑狼疮(NCT04181762)轴向SpA(21)(NCT04156620,NCT04732117)Hiradenitissupprativa(NCT03713619,NCT03713632,NCT04179175)巨细胞动脉炎(NCT04930094)Grave眼病(NCT03713619)IL-17R抗体溴达利尤单抗牛皮癣轴向SpA(22)PsA(23)不锈钢(NCT03957681)IL17A/F抗体比莫珠单抗AS(NCT03928743)轴向SpA(NCT03928704,NCT04436640)银屑病(24,25)(NCT03598790,NCT03766685)PsA(NCT03895203、NCT03896581、NCT04009499NCT04109976)Hiradenitissuppruativa(NCT04242446,NCT04242498,NCT04901195)IL-23抗p40mAb抗体乌司奴单抗银屑病、PsA、UC、CD特发性炎性肌炎(NCT03981744)高安动脉炎(NCT04882072)抗p19mAb抗体古塞利尤单抗银屑病,PsAUC(NCT04033445)CD(NCT03466411,NCT04397263)瑞沙珠单抗牛皮癣PsA(26,27)UC(NCT03398135,NCT03398148)CD(NCT03104413、NCT03105102、NCT03105128NCT04524611)替尔拉奇珠单抗牛皮癣PsA(NCT03552276、NCT04314544、NCT04314531NCT04991116)米利珠单抗银屑病(NCT03482011、NCT03535194NCT03556202)UC(NCT03518086、NCT03519945NCT03524092)CD(NCT03926130,NCT04232553)1型IFN抗IFNR1单克隆抗体Anifrolumab系统性红斑狼疮备注:该表包括具有一种或多种已批准自身免疫性疾病适应症的药物。该适应症仅涵盖自身免疫性疾病领域。pJIA,多关节幼年特发性关节炎;UC,溃疡性结肠炎;CD,克罗恩病;BD,白塞病;sJIA,系统性幼年特发性关节炎;DIRA,IL-1受体拮抗剂缺乏;TRAPS,TNF受体相关周期性综合征;HIDS/MKD、高免疫球蛋白D综合征/甲羟戊酸激酶缺乏症;FMF,家族性地中海热;CRS,细胞因子释放综合征;CAR-T,嵌合Ag受体-T细胞;SSc相关ILD、系统性硬化症相关间质性肺病、PMR、风湿性多肌痛、NMOSD、视神经脊髓炎谱系疾病;中轴型SpA,中轴型脊柱关节炎。*尽管III期临床试验取得了积极结果,但由于安全性问题,FDA并未推荐将sirukumab用于治疗RA。表2.用于治疗自身免疫性疾病的细胞靶向疗法靶细胞结构药物临床应用正在调查中(IIb或III期)B细胞抗CD20mAb抗体利妥昔单抗RA类寻常型天疱疮(28)GPA、MPA超说明书使用:MS、免疫性血小板减少症奥瑞珠单抗女士奥法木单抗女士乌布利妥昔单抗MS(NCT03277261、NCT03277248NCT04130997)抗CD19mAb抗体因比利珠单抗NMOSDIgG4RD(NCT04540497)重症肌无力(NCT04524273)抗BAFF单克隆抗体贝利尤单抗系统性红斑狼疮抗BAFF-R单克隆抗体伊那单抗系统性红斑狼疮(NCT05126277)pSS(29)T细胞CTLA4-IgG1Fc阿巴西普RA,pJIApSS(NCT02067910,NCT02915159)PsA(30)特发性炎性肌炎(NCT02971683)GPA(NCT02108860)CD40mAb抗体伊斯卡利单抗pSS(NCT03905525)备注:该表包括已批准用于自身免疫性疾病或基于II期试验的积极结果正在临床开发的药物。GPA,肉芽肿性多血管炎;MPA,显微镜下多血管炎;NMOSD,视神经脊髓炎谱系疾病;IgG4RD,免疫球蛋白G4相关疾病;pJIA,多关节幼年特发性关节炎。表3.用于治疗自身免疫性疾病的激酶靶向疗法靶标激酶结构药物临床应用正在调查中(IIb或III期)杰克JAK1/3抑制剂托法替布RA类贾(31)(NCT01500551,NCT03000439)PsAAS(32))UC(英语)JAK1/2抑制剂巴瑞替尼RA类系统性红斑狼疮(NCT03843125,NCT03616912,NCT03616964)JIA(NCT03773965,NCT03773978)sJIA(NCT04088396)特应性皮炎(33,34)葡萄膜炎(NCT04088409)JAK1选择性抑制剂乌帕替尼RA类CD(NCT03345823、NCT03345836NCT03345849)PsA加州大学(35)(NCT03006068,NCT03653026)轴向SpA(NCT04169373)特应性皮炎(36,37)(NCT03661138,NCT04195698)高安动脉炎(NCT04161898)巨细胞动脉炎(NCT03725202)非戈替尼RA(由EMA和日本提供)统一(38)(NCT02914535)CD(NCT02914561,NCT02914600)TYKTYK2选择性抑制剂Deucravacitinib银屑病(NCT03624127,NCT03611751)PsA(NCT04908189,NCT04908202)BTK公司BTK抑制剂Evobrutinib(依布替尼)MS(NCT04338022,NCT04338061)托布替尼MS(NCT04410978、NCT04410991、NCT04411641NCT04458051)重症肌无力(NCT05132569)非布替尼MS(NCT04544449、NCT04586010NCT04586023)利扎布替尼寻常型天疱疮(NCT03762265)免疫性血小板减少症(NCT04562766)备注:该表包括已批准用于自身免疫性疾病或基于II期试验的积极结果正在临床开发的药物。UC,溃疡性结肠炎;sJIA,系统性幼年特发性关节炎;CD,克罗恩病;中轴型SpA,中轴型脊柱关节炎。【NO.3】细胞因子靶向治疗肿瘤坏死因子(TNF) TNF是一种主要由髓系细胞和活化T细胞产生的促炎细胞因子。RA滑膜中TNF表达的增加和TNF转基因小鼠中关节炎的发展表明TNF在慢性炎症中的致病作用。抗TNF治疗的成功彻底改变了RA患者的治疗策略。自1998年英夫利昔单抗和依那西普首次获批以来,已有4种单克隆抗体(英夫利昔单抗、阿达木单抗、戈利木单抗和赛妥珠单抗)和1种受体-Fc融合蛋白(依那西普)获批,目前可用于治疗慢性免疫介导的疾病,包括RA、幼年特发性关节炎(JIA)、强直性脊柱炎(AS)、银屑病和银屑病关节炎(PsA)。这种mAb也适用于治疗炎症性肠病和非感染性葡萄膜炎。 尽管TNF具有促炎作用,但它是一种多效性细胞因子,依赖于TNF受体(TNFR)的结合。TNFR1在几乎所有有核细胞上组成性表达,主要负责TNF的炎症功能,而TNFR2仅在特定细胞类型上表达,例如髓源性抑制细胞、Treg细胞和单核细胞,与TNF的调节功能相关。源自TNFR1和TNFR2的不同信号转导通路已在其他地方进行了综述。目前可用的抗TNF疗法同时抑制TNFR1和TNFR2。由于TNF的调节方面,TNF阻断可能反常地诱导Th1/Th17细胞扩增和IFN反应失调,这可以解释抗TNF治疗期间治疗失败、自身抗体生成和反常银屑病的原因。因此,正在研究抑制TNFR1和增强TNFR2的更多选择性治疗。IL-1 IL-1α和IL-1β是IL-1家族的成员,是促炎细胞因子,与先天免疫反应密切相关。尽管IL-1α和IL-1β通过与IL-1受体1(IL-1R1)结合而具有共享生物学功能,但IL-1α与IL-1β的几个特征是不同的。在间充质细胞中组成型表达的pro-IL-1α具有生物活性,而巨噬细胞产生的pro-IL-1β需要被caspase-1切割才能成为活性IL-1β。pro-IL-1β的Caspase-1依赖性裂解是通过激活包含核苷酸结合结构域成员和包含亮氨酸富集重复序列的[NLR]蛋白家族(例如NLR家族含pyrin结构域的[NLRP]1、NLRP3、NLR家族CARD结构域4)或包含PYRIN-HIN-200结构域的蛋白家族成员(例如,在黑色素瘤2中不存在)的炎性小体激活来介导的)。此外,与IL-1β相反,IL-1α在体循环中未检测到,这表明IL-1α在自身免疫性疾病中的致病作用是局部的,而不是全身的。目前,IL-1β被认为比IL-1α与多种风湿性疾病更密切相关,包括全身性JIA、成人发病斯蒂尔病(AOSD)和痛风,以及与遗传性自身炎症性疾病的相关性,例如冷热蛋白相关周期性综合征(CAPS)和家族性地中海热。 被IL-1α或IL-1β占据后,IL-1R1与IL-1R3形成异源三聚体复合体,以募集髓样分化初级反应基因88(MYD88),从而触发随后的激酶级联反应(IL-1R相关激酶[IRAK]、IκB激酶、IκB和NF-κB),从而促进促炎状态。IL-1的这种炎症活性受来自同一IL-1家族的天然IL-1R拮抗剂(IL-1Ra)的调节。IL-1Ra占据IL-1R1导致构象变化,阻碍异源三聚体复合物与IL-1R3的形成,从而阻碍IL-1介导的炎症过程。 目前,已有3种蛋白质疗法被批准用于抗IL-1疗法:canakinumab,一种抗IL-1βmAb;anakinra,一种重组IL-1受体拮抗剂;和rilonacept,一种IL-1R1-Fc融合蛋白。根据它们的分子结构,所有3种药物都阻断IL-1β,阿那白滞素和利洛西普也抑制IL-1α。作为一种抑制IL-1信号转导的新治疗方法,口服NLRP3抑制剂,包括达潘舒腈(OLT177),正在研究中。 在早期临床开发中,阿那白滞素被测试为RA的治疗方法。尽管阿那白滞素在RA患者中的治疗效果已得到证实,但由于其成本效益低,因此不推荐将阿那白滞素作为一线生物疗法。抗IL-1疗法更广泛地用于自身炎症性疾病,如全身性JIA、AOSD和CAPS。其他具有高炎症负荷的疾病,例如痛风和复发性心包炎,也可通过IL-1靶向治疗进行控制。由于IL-1在炎症性疾病中的广泛作用,IL-1阻断有望在治疗顽固性自身免疫性疾病(包括SLE和系统性硬化症)以及控制过度的促炎反应(如细胞因子释放综合征和巨噬细胞激活综合征)方面提供临床益处。IL-6 IL-6是一种多效性细胞因子,由各种细胞类型在感染、炎症和恶性肿瘤的情况下产生。IL-6最初被鉴定为T细胞分泌的“B细胞分化因子”或“B细胞刺激因子”。尽管抗IL-6疗法在B细胞成熟中起着关键作用,但其对多发性骨髓瘤患者的治疗效果不佳。然而,托珠单抗(第一种抗IL-6R阻断单克隆抗体)的IL-6靶向治疗被证明在RA中具有显着的临床益处,甚至在疗效上优于阿达木单抗。托珠单抗目前被批准用于治疗RA、JIA、AOSD、巨细胞动脉炎和细胞因子释放综合征,因为它能够调节全身性过度炎症。最近,已研究抗IL-6疗法在SLE、视神经脊髓炎和系统性硬化症中的治疗应用。 IL-6在生理和病理条件下具有多种生物学功能。在生理状态下,IL-6负责巨噬细胞分化为M2状态,通过成骨细胞上RANK配体表达的增加进行破骨细胞生成,以及通过肝脏中的JAK-STAT通路进行急性期反应。在病理(炎症)条件下,IL-6通过调节FOXP3、RORC和IL-23R表达,关键参与Th17分化。IL-6对滤泡辅助性T细胞的发育和B细胞的成熟也很重要。 IL-6信号转导通过IL-6R和糖蛋白130(gp130)的复合物转导。gp130二聚化依次激活多个信号转导通路,包括JAK-STAT、MAPK、PI3K和YES相关蛋白1,这些蛋白转位到胞核并控制与细胞生长、增殖和炎症相关的基因转录。为了干扰IL-6信号通路,抗IL6疗法可以靶向IL-6、IL-6R、gp130、JAK和STAT3。然而,对副作用的担忧限制了gp130和STAT3作为治疗靶点的潜力。因此,抗IL6mAb、抗IL-6RmAb和JAK抑制剂已被用于阻断IL-6信号转导,并且使用可溶性gp130抑制IL-6/IL-6R复合体的可能性正在研究中。IL-17 IL-17A,通常称为IL-17,是CD4+T细胞Th17亚群的标志性细胞因子,但它也由CD8+T细胞(Tc17)、γδT细胞、自然杀伤T细胞、第3组先天性淋巴细胞和中性粒细胞产生。在生理状态下,Th17细胞通过募集中性粒细胞、宿主对细菌和真菌的防御以及皮肤和粘膜部位的组织修复来促进先天免疫。在病理条件下,IL-17A与TNF和其他炎性趋化因子协同作用,促进自身免疫。炎症性关节炎和神经炎症的动物模型表明,Th17细胞而不是Th1细胞在这些疾病的发展中起主要作用。 Th17细胞在IL-1β、IL-6和TGF-β存在下,通过抑制FOXP3并激活STAT3和RORC来源于初始CD4+初始T细胞。随后,IL-23稳定致病性Th17细胞的增殖和存活。与IL-17A结合后,IL-17R亚基A(IL-17RA)和亚基C(IL-17RC)的称为SEF/IL-17R的独特胞质结构域募集接头蛋白Act1,从而触发TNF受体相关因子(TRAF)6的泛素化,随后激活NF-κB、MAPK和激活蛋白1(AP1)通路和C/EBP转录因子。 来自动物和人类研究的越来越多的证据表明,IL-23/IL-17轴是多种自身免疫性疾病(如AS、PsA和RA)的极好治疗靶标。目前的抗IL-17疗法包括IL-17A(苏金单抗和依奇珠单抗)和IL-17RA(brodalumab)的mAb。正如预期的那样,抗IL-17疗法在银屑病、PsA和AS中产生了显著的反应。出乎意料的是,这种方法在RA(一种Th17依赖性疾病)患者中未能显示出显着的临床疗效。这种不令人满意的结果可以通过疾病本身的异质性或IL-17A的不同致病作用来解释,具体取决于RA分期(例如早期与晚期)。IL-23 IL-23是一种由DC和活化的巨噬细胞分泌的促炎细胞因子。作为IL-12家族的一员,IL-23是一种异二聚体,由IL-12共有的p40亚基(IL-12/IL-23p40)和IL-23特有的p19亚基(IL-23p19)组成。尽管IL-12和IL-23共享一个结构亚基,但IL-23更重要、更广泛地参与自身免疫性疾病的发病机制。最重要的是,IL-23通过维持Th17特征基因、抑制抑制因子、上调IL-23R表达和诱导效应基因来稳定Th17细胞的致病特征。它还作为自分泌因子促进DC和巨噬细胞的促炎功能。 IL-23与由IL-12Rβ1(与IL-12/IL-23p40结合)和IL-23R(与IL-23p19结合)组成的受体复合体相互作用,它们分别与酪氨酸激酶(TYK)2和JAK2结合。TYK2和JAK2的激活导致STAT的磷酸化和核转位,主要是STAT3。通过靶向抑制IL-12/IL-23p40或IL-23p19,可以阻断IL-23信号传导。作为一种抗IL-12/IL-23p40mAb,乌司奴单抗可阻断IL-12和IL-23,而抗IL-23p19mAb(guselkumab、tildrakizumab、risankizumab和mirikizumab)仅抑制IL-23。 与抗IL-17治疗类似,IL-23抑制可有效治疗银屑病和PsA。然而,与抗IL17治疗相比,靶向p40和p19亚基的mAb均未能改善AS的临床病程。尽管IL-23在AS的临床前模型中具有明显的致病作用,但这种意外结果表明,IL-23在人类自身免疫性疾病的组织和时间依赖性环境中发挥着不同的作用。在克罗恩病中,乌司奴单抗成功改善了临床结局,抗IL-23p19mAb的临床试验正在进行中(表1)。1型IFN 1型IFN,包括IFN-α、IFN-β、IFN-ε、IFN-κ和IFN-ω,最初被鉴定为可溶性抗病毒因子。随后的研究表明,IFN-α在自身免疫性疾病,尤其是SLE的发病机制中起着至关重要的作用。SLE患者的临床数据显示1型IFN特征的表达显著增加。重组IFN-α治疗后SLE样综合征的发展也表明1型IFN在自身免疫性疾病中的病理作用。 虽然大多数有核细胞可以产生1型IFN,但主要的细胞来源是pDC。含核酸的细胞外刺激,例如分别与抗RNA和DNA自身抗体复合的RNA和DNA,与pDC中的Toll样受体7(TLR7)和TLR9相互作用,以募集MYD88并激活IRAK和TRAF,从而导致IFN调节家族(IRF)7易位并导致IFN-α转录)。1型IFN与由IFNAR1和IFNAR2组成的IFN-α/β受体(IFNAR)结合。与1型IFN结合后,IFNAR1和IFNAR2分别激活JAK1和TYK2,从而导致STAT1和STAT2磷酸化和核转位。在胞核中,STAT1/STAT2与IRF9一起诱导IFN刺激基因的表达。在SLE中,IFN-α通过刺激髓系DC、Th1细胞和B细胞以及抑制Treg来促进促炎反应。 IFN-α在SLE中的病理生理学意义导致了1型IFN靶向免疫治疗的发展。在SLE中测试了Rontalizumab和sifalimumab中和干扰素α的单克隆抗体,但未能控制疾病活动。尽管IFN-α以外的IFN的作用尚不清楚,但仅抑制IFN-α而保持IFN-β和IFN-κ活性可能解释了SLE治疗效果不足的原因。最近,anifrolumab是一种靶向IFNAR1以阻断所有1型IFN生物学功能的人单克隆抗体,已被批准用于中度至重度SLE。Anifrolumab在减少疾病活动、口服皮质类固醇使用和年化发作方面显示出一致的临床益处。然而,狼疮性肾炎和神经精神性狼疮患者被排除在临床试验之外。 几种阻断1型IFN的新治疗方法正在研究中。为了减少1型IFN的产生,药物靶向pDC和信号转导分子,如TLR、MyD88和IRAK4。激酶抑制剂也正在临床开发中,用于治疗各种自身免疫性疾病,具体取决于它们抑制IFNAR下游信号通路的能力。【NO.4】细胞靶向治疗B细胞 随着我们对B细胞功能的理解不断扩大,B细胞被认为是自身免疫性疾病的积极参与者。有趣的是,B细胞耗竭疗法在RA和多发性硬化症(MS)中的成功突出了B细胞在自身免疫中的病理意义。除了在Ab产生中发挥作用外,B细胞还通过Ag呈递、三级淋巴组织的形成和细胞因子(如IL-6、TNF、IFN-γ和GM-CSF)的产生积极参与自身免疫。B细胞的Ab非依赖性功能解释了RA和MS中B细胞耗竭疗法的治疗效果,尽管没有自身抗体减少。 B细胞在骨髓中产生,并在外周组织中依次分化为Ag特异性B细胞。B细胞分化通过体细胞超突变和免疫球蛋白的类别转换重组,伴随着B细胞表面标志物的变化,继续增加对Ag的亲和力。CD20仅在从前B细胞到记忆B细胞的B细胞谱系中表达,但不在浆细胞中表达(图1)。在过去的几十年里,抗CD20疗法一直是B细胞耗竭的主要工具。利妥昔单抗是一种嵌合抗CD20mAb,可将CD20再分布到脂筏中,然后激活补体依赖性细胞毒性和Ab依赖性细胞毒性(ADCC)。利妥昔单抗有效消除CD20+B细胞会耗尽分泌Ab的浆母细胞的细胞来源,并阻止不依赖Ab的B细胞功能,从而减轻自身免疫性炎症。随着利妥昔单抗在RA和MS中的临床成功,已经开发了具有不同结合表位、不同给药途径和先进治疗效果的多种抗CD20疗法。Ocrelizumab和ofatumumab是人源化抗CD20mAb,已被批准用于复发性MS,其他抗CD20mAbobinutuzumab和ublituximab的临床试验正在进行中(表2)。 但是,利妥昔单抗在治疗SLE方面并未完全成功,SLE是刻板的B细胞介导的疾病之一。除了SLE患者的异质性外,利妥昔单抗治疗失败还可能由于存在自身反应性CD20−(但CD19+)长寿命浆细胞、外周血和组织中B细胞不完全耗竭或B细胞重建过程中的疾病发作。为了广泛抑制对抗CD20治疗耐药的B细胞,B细胞耗竭疗法靶向CD19,CD19在CD20+B细胞以及CD20-浆母细胞和一些浆细胞上表达。人源化抗CD19mAbinebilizumab被批准用于治疗视神经脊髓炎谱系疾病,并且正在进行临床试验以治疗其他炎症性神经系统疾病(表2)。 抑制B细胞的另一种方法是阻断B细胞存活因子,特别是BAFF和APRIL。BAFF与其3种不同受体连接后,与B细胞成熟和存活密切相关:1)BAFF受体(BAFF-R,称为TNFRSF13C),在除浆细胞外的大多数B细胞亚群上表达;2)跨膜激活剂、钙调节剂和亲环蛋白配体相互作用剂(TACI;称为TNFRSF13B),在边缘区B细胞、记忆B细胞和浆细胞上表达;3)B细胞成熟Ag(BCMA;称为TNFRSF17)在浆母细胞和浆细胞上表达。与BAFF-R不同,TACI和BCMA也与APRIL结合,这对Ab类别转换和浆细胞存活很重要。 鉴于B细胞成熟、增殖和存活的重要作用,BAFF/APRIL系统被认为是SLE及其相关自身免疫性疾病中一个有前途的治疗靶点。贝利尤单抗是一种人源化抗BAFFmAb,是FDA批准用于SLE的第一个靶向免疫疗法。然而,贝利尤单抗并不总是对所有SLE患者具有普遍的治疗益处。Ianalumab是一种抗BAFF-R的单克隆抗体,在原发性干燥综合征(pSS)患者的II期试验中显示出有希望的结果。作为B细胞耗竭疗法,ianalumab有2种作用模式:通过增强ADCC裂解B细胞和阻断BAFF信号传导。Telitacicept是一种TACI-Ig融合蛋白,基于其对BAFF/APRIL系统的抑制作用,也正在临床开发中。T细胞 作为适应性免疫的关键调节因子,T细胞在自身免疫的发生和发展中起着关键作用。T细胞效应器功能需要TCR的Ag识别和共刺激受体的额外参与。因此,已经研究了这些共刺激分子的调节用于自身免疫性疾病和恶性肿瘤的T细胞靶向治疗。 CD28信号转导是通过激活MAPK、AKT和NF-κB通路进行T细胞激活和分化的一种众所周知的共刺激通路。CD4+T细胞上表达的CD28与Ag呈递细胞上的CD80或CD86结合,CTLA-4作为CD28的抑制性对应物共享。基于CD28和CTLA-4的反调节,开发了一种由CTLA4胞外结构域和IgGFc区(CTLA4-Ig)组成的融合蛋白,通过占据CD80和CD86来抑制CD28信号传导。第一个CTLA4-Ig阿巴西普被批准用于治疗RA和JIA,已证实对控制炎症性关节炎有效。随后,另一种与CD80和CD86结合改善的CTLA4-Igs(包括belatacept和MEDI5256)已被研究用于临床应用。尽管贝拉西普于2011年被批准用于肾移植受者,但贝拉西普在基于钙调磷酸酶抑制剂的常规方案之外的额外临床益处存在争议。 CD40通路是T细胞效应器功能的主要激活信号。CD40L与CD40连接后,CD80和CD86表达上调。当活化T细胞上的CD40L与靶细胞上的CD40结合时,多个激酶级联反应会激活转录因子,如NF-κB和AP1,以诱导细胞存活、增殖和分化。CD40信号转导对于参与T细胞依赖性Ab反应、生发中心形成和记忆B细胞分化的B细胞-T细胞相互作用尤为重要。由于其在B细胞功能中的关键作用,靶向CD40信号转导的治疗潜力已在临床前和临床研究中得到研究。iscalimab(一种人源化抗CD40mAb)最近的II期试验显示pSS患者的临床改善,随后的III期试验正在进行中(表2)。 靶向其他共刺激信号转导的免疫疗法,如诱导型T细胞共刺激因子(ICOS)和OX40通路,也正在开发中,以抑制自身免疫性疾病中的T细胞效应功能。作为在活化的CD4+T细胞上表达的共刺激分子,ICOS和OX40参与T细胞的存活、分化和活化。【NO.5】激酶靶向治疗 如前所述,将可溶性炎症介质与其同源受体结合通过激活细胞内激酶(通常是JAK家族)来转导信号。JAK家族由JAK1、JAK2、JAK3和TYK2组成,与细胞因子受体(包括IL-2R、IL-4R、IL-5R、IL-6R、IL-13R和1型IFN)、生长激素和促红细胞生成素有关。JAK家族的激活导致STAT的磷酸化、二聚化和核转化。在细胞核中,STAT有助于参与细胞分化、增殖和存活、细胞因子产生和血管生成的基因转录。 由于JAK在造血中的关键作用,JAK抑制剂首次被评估用于治疗血液病,尤其是骨髓增生性肿瘤。自ruxolitinib(一种JAK1和JAK2抑制剂)于2011年首次被批准用于治疗骨髓纤维化以来,许多激酶抑制剂已被批准或研究用于治疗血液系统恶性肿瘤和炎症性疾病。几种JAK抑制剂已根据其经证实的临床疗效被批准用于RA、PsA和溃疡性结肠炎。每种JAK抑制剂对JAK的选择性不同,但尚未证明JAK抑制剂之间的治疗效果存在差异。Tofacitinib和baricitinib分别主要靶向JAK1/3和JAK1/2。Upadacitinib和filgotinib是第二代JAK抑制剂,可选择性抑制JAK1。 与上述调节细胞外间隙细胞激活信号的免疫疗法相比,JAK抑制剂靶向细胞内间隙的信号通路。JAK靶向治疗会抑制来自多个细胞因子受体的收敛信号,并破坏反馈回路。因此,即使部分阻断选定的激酶也可以有效地下调多种炎症信号通路,减轻自身免疫性炎症。应该注意的是,在一项头对头的随机对照试验中,巴瑞替尼显示出比抗TNFmAb阿达木单抗更好的临床反应。 除JAK抑制剂外,选择性TYK2抑制剂deucravacitinib正在等待临床批准,作为银屑病的首个口服靶向治疗。TYK2介导源自IL-12、IL-23和1型IFN的细胞内炎症信号。根据对PsA、炎症性肠病和SLE患者的机制见解,目前正在研究deucravacitinib在PsA、炎症性肠病和SLE患者中的治疗潜力(表3)。 布鲁顿酪氨酸激酶(BTK)抑制剂也有望通过调节B细胞功能来改善自身免疫性炎症。目前正在研究BTK抑制剂在各种自身免疫性疾病中的应用,包括RA、MS、pSS和SLE。最近一些使用BTK抑制剂的II期试验在复发性MS患者中显示出有希望的结果。 激酶抑制的未来方向是基于先进的分子技术开发更具选择性的抑制剂,具有最小的脱靶效应和更高的器官特异性。此外,应广泛研究由不受调节的细胞行为引起的除改善炎症以外的靶向效应。最近的证据表明,接受托法替布治疗的患者面临心脏事件、恶性肿瘤、血栓形成和死亡的风险增加,FDA已决定修改JAK抑制剂的黑框警告。自身免疫性疾病的慢性病程引发了对长期药物使用的安全性担忧,这会严重影响患者和医生的药物选择。【NO.6】新兴免疫疗法 随着对自身免疫性疾病免疫发病机制的更好理解和生物技术的不断进步,许多具有新治疗靶点和先进疗效的药物不断被开发出来,显示出有希望的疗效。尽管如此,仍然存在未满足的医疗需求,例如异质性治疗效果和免疫抑制引起的不良事件。为了克服当前治疗的局限性,炎症性疾病的治疗方法已经多样化和个体化。在这里,我们简要介绍了由先进分子工程技术实现的靶向免疫治疗的新视角。嵌合抗原受体(CAR)T细胞疗法 CART细胞疗法的基本概念是施用含有基因工程TCR的自体T细胞,以捕获肿瘤特异性Ag并通过增加细胞毒性来消除肿瘤细胞。在弥漫性大B细胞淋巴瘤患者治疗成功后,CD19CART细胞疗法被批准用于治疗B细胞淋巴瘤和急性淋巴细胞白血病。 CAR是由胞外Ag识别结构域、跨膜结构域和胞内T细胞激活结构域组成的工程化受体。细胞外结构域,也称为单链Fv,被设计为单克隆抗体的可变重链和轻链。细胞外结构域对Ag的识别会激活细胞内结构域上基于免疫受体酪氨酸的激活基序,导致细胞因子的产生和靶细胞的裂解。为了提高治疗效果,细胞内结构域由一个激活结构域CD3ζ和一个共刺激结构域(如CD28)组成。 尽管CART细胞最初被引入肿瘤学领域,但它们消除病理细胞的治疗潜力延伸到自身免疫性炎症性疾病的治疗。最近,Mougiakakos等人报道了自体CD19CART细胞疗法在常规治疗难治性SLE患者中的快速临床缓解。在该患者中,单次给药后7周内可在外周血中检测到输注的CD19CART细胞,抗dsDNA抗体快速且持续下降。这是一个有希望的结果,因为目前抗CD20mAb的B细胞耗竭需要定期注射并注意免疫原性以维持初始治疗效果。 随着工程T细胞疗法的发展,嵌合自身抗原受体(CAAR)T细胞和CARTreg疗法作为自身免疫性疾病的新型治疗策略而受到关注。CAART细胞的胞外结构域表达一种自身抗原,该抗原可与Ag特异性自身反应性B细胞和T细胞相互作用。CAART细胞疗法可能对具有已知自身抗原的自身免疫性疾病有效。CARTreg细胞的设计也期望产生Ag特异性免疫调节反应,而输注多克隆Treg细胞无法充分实现这种反应。然而,这种针对自身免疫性疾病的工程化T细胞疗法尚未得到广泛研究。此外,尽管工程化T细胞疗法具有假设的治疗效果,但细胞因子释放综合征和神经毒性可能会限制对细胞疗法在自身免疫性疾病中使用的热情,尤其是在高炎症微环境中。低剂量IL-2疗法 IL-2是Treg细胞分化、激活和存活的关键细胞因子,主要由活化的CD4+T细胞产生。Treg定义为CD4+FOXP3+CD25+CD127低表达,通过分泌抗炎细胞因子(IL-10、肿瘤生长因子-β和IL-35)、DC诱导免疫抑制酶(吲哚胺2,3-双加氧酶)、效应T细胞和NK细胞失活以及对CD8+T细胞和NK细胞的直接细胞毒性。Treg细胞缺陷和/或功能障碍常见于RA、SLE、pSS和AS等各种自身免疫性疾病。 除了激活Treg细胞外,IL-2还诱导效应T细胞的存活和增殖,并抑制Th17细胞分化。基于其对常规T细胞的刺激作用,大剂量IL-2疗法首次被批准用于转移性肾细胞癌和转移性黑色素瘤。然而,后来的研究表明,IL-2的主要作用是通过在Treg细胞上表达的高亲和力IL-2R介导的。IL-2R以单体、二聚体和三聚体变体表达,三聚体IL-2R的亲和力高于单体和二聚体形式。由于Treg细胞在高水平上组成性表达三聚体IL-2R,因此Treg细胞对IL-2比效应记忆CD4+T细胞高度敏感。因此,已在自身免疫性疾病中评估了低剂量IL-2疗法(0.3至300万国际单位/天),预计它将通过Treg刺激诱导免疫耐受,同时对效应T细胞的影响最小。 在自身免疫性疾病(包括SLE、PsA和丙型肝炎病毒诱导的冷球蛋白血症血管炎)患者中,低剂量IL-2疗法改善了临床结果,这与Treg细胞的增加一致。在临床试验中,低剂量IL-2具有可耐受的安全性,并且与感染风险增加无关。此外,在小鼠中,低剂量IL-2长期治疗不会损害对疫苗接种、感染和癌症的免疫反应。 良好的临床试验结果导致开发了氨基酸序列改变的工程化IL-2蛋白(IL-2突变蛋白),以提高选择性并减少不良反应。IL-2与生物疗法(如TNF和IL-6抑制)的组合也正在研究中。免疫耐受诱导 在不破坏免疫系统其他部分的情况下诱导对自身抗原的免疫耐受是治疗自身免疫性疾病的理想方法。在这方面,可以诱导Ag特异性免疫耐受的口服耐受性已经研究了一个多世纪。肠道相关淋巴组织(GALT)是最大的免疫器官,可维持对大量食物和共生微生物的耐受性。鉴于GALT在肠道稳态和全身调节中的作用,饲喂Ags对系统性自身免疫性疾病的耐受性影响已在临床前和临床试验中得到广泛研究。在动物模型中,发现口服耐受诱导可有效预防甚至治疗各种炎症性疾病,包括炎症性关节炎、实验性自身免疫性脑炎、糖尿病和葡萄膜炎。根据Ag的剂量,低剂量的Ag会促进分泌IL-4、IL-10和TGF-β的Treg细胞的产生,而高剂量的Ag会促进特定T细胞的克隆缺失或无反应。然而,这种免疫耐受机制并不排斥,可以重叠。 口服耐受诱导的早期试点试验和II期试验也显示出对RA、MS和葡萄膜炎患者有希望的结果,而没有治疗相关的毒性。然而,在RA和MS患者中进行Ag喂养的III期试验显示治疗效果不佳。尽管Ag喂养具有实验效果和可接受的安全性,但仍需要解决未解决的问题才能成功诱导免疫耐受:(1)Ag喂养方案(Ag的剂量和类型、粘膜佐剂的使用和给药频率);(2)与常规免疫抑制药物联合治疗;(3)反映口服耐受性发展有效性的生物和免疫标志物;4)选择适合诱导口服耐受的患者(年龄、疾病发作和脱敏史)。 抗原特异性耐受性的另一种方法是递送自身抗原的耐耐受性疫苗。致耐受性疫苗已成功诱导Ag特异性Treg细胞,并在自身免疫性疾病的动物模型中促进自身反应性T细胞无反应和细胞凋亡。已经研究了几种耐受性原疫苗平台,包括基于蛋白质/肽、纳米颗粒、细胞和DNA/RNA的疫苗,以增强MS临床前和临床研究中的免疫原性。尽管使用肽疫苗的III期试验未能显示出临床益处,但仍在使用MS患者的多种疫苗平台对耐受性方法进行研究。 最近,Krienke等人报道了在髓鞘少突胶质细胞糖蛋白(MOG35-55)诱导的实验性自身免疫性脑脊髓炎小鼠模型中,使用基于非炎性mRNA的疫苗成功诱导免疫耐受。尽管双链RNA分子在细胞外环境中具有固有的促炎性,但用1-甲基假尿苷(m1Ψ)取代尿苷会降低其促炎性质。MOG35-55编码m1Ψ修饰的单链mRNA疫苗可预防小鼠疾病的发展和进展。致耐受性疫苗诱导MOG35-55特异性FOXP3+Treg细胞并抑制MOG33-35特异性Th1和Th17细胞。PD1和CTLA4等抑制分子在Ag特异性细胞上的表达上调,疫苗的保护作用被PD1和CTLA-4靶向检查点抑制剂消除。 尽管如此,耐受性疫苗的开发具有挑战性,因为哪些自身抗原对自身免疫性疾病具有特异性尚无定论且存在争议,并且多种自身抗原可能涉及大多数自身免疫性疾病。【NO.7】结论 过去几十年来靶向免疫治疗的进步彻底改变了自身免疫性疾病患者的治疗和临床结果。目前的靶向免疫疗法通过阻断炎性细胞因子、细胞表面分子和细胞内激酶来抑制主要的促炎信号通路。尽管靶向治疗在自身免疫性疾病中取得了巨大成功,但在药物疗效和长期安全性方面仍未满足医疗需求。除了阻断炎症信号通路外,未来的疗法还旨在诱导长期的免疫耐受,同时保持保护性免疫功能。希望生物技术的进步和疾病知识将为开发具有更高治疗效果和最小不良反应的新药提供机会。此外,考虑到炎症介质和免疫细胞的多方面作用,需要开发更具选择性和特异性的药物,同时更精确地了解疾病发病机制。识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!请注明:姓名+研究方向!本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
免疫疗法
2025-04-28
·靶点圈
IL-1/IL-1R概述1IL-1家族IL-1家族是一类重要的细胞因子,包含IL-1、IL-33和IL-36等多种成员,它们分别与不同受体结合,诱导受体与IL-1RAcP形成异聚体,招募MyD88启动信号级联反应,促进炎症基因表达。而IL-1家族受体(IL-1Rs)属于Ig样受体超家族,具有Toll/白细胞介素-1受体(TIR)结构域,与先天免疫反应相关。图1 IL-1家族细胞因子及其受体概述2IL-1的复杂生物学特性白细胞介素-1(IL-1)作为免疫和炎症反应的调节因子,对多种细胞尤其是免疫细胞有重要影响。IL-1在介导肿瘤、自身炎症、自身免疫、感染和退行性疾病中发挥关键作用,在中枢神经系统中,IL-1诱导发热和下丘脑-垂体-肾上腺(HPA)轴的激活。IL-1基因定位于人和小鼠的2号染色体,其活性在基因转录、表达、分泌和受体结合等多个层面受到调控。它有IL-1α和IL-1β两种形式,由不同的基因编码,合成与释放机制各有不同,尽管它们结合相同的受体并显示出相似的生物学特性,但对炎症和癌症的影响不同。其中IL-1β在生物学活性和疾病中的作用最为显著,目前针对IL-1β的研究也最为深入。图2 IL-1介导的炎症机制和治疗靶点①IL-1α:在多种细胞中组成性表达,可定位于细胞核、细胞质和细胞膜,在不同部位具有不同功能。细胞凋亡时,它与染色质紧密结合,不诱导炎症;而在坏死信号存在时,它被释放并激活炎症反应,还可能作为癌蛋白促进肿瘤发展。②IL-1β:主要由造血细胞响应TLR刺激而产生,IL-1β前体(pro-IL-1β)无功能活性,需要在炎性小体(如NLRP3)的作用下由蛋白酶切割激活,可通过多种途径释放,分泌受到严格调控。此外,IL-1β可激活炎症相关基因、影响细胞代谢活动基因、调节免疫反应相关基因的表达,可诱导其他促炎细胞因子、趋化因子等的合成,参与适应性免疫反应的调节,具有多种生理和病理功能,在血管病理、风湿性疾病和恶性肿瘤中发挥重要作用。3IL-1R复合物的组成部分及其功能IL-1R1:IL1-R1是位于细胞表面的膜蛋白,由三个胞外结构域和一个胞内结构域组成,主要负责启动IL-1介导的细胞信号传导,与IL-1结合后招募IL-1R3形成三聚体信号复合物,激活细胞内信号通路,最终引发多种细胞反应,其功能异常与多种免疫和炎症性疾病相关。图3 特异性表达IL1R1的细胞系和组织IL-1R2:IL-1R2结构与IL-1R1相似,是IL-1的诱饵受体,可结合IL-1α和IL-1β,但因缺乏细胞内TIR结构域无法启动信号级联反应。它可作为IL-1的储存库和运输载体,其表达受多种因素调节,在不同疾病状态下表达水平有所变化,基因多态性也会影响其功能。图4 免疫细胞中IL-1R1和IL-1R2的诱导及其功能IL-1R3(IL-1RAcP):作为共受体,能与多种IL-1家族细胞因子的配体结合受体形成异聚体复合物,促进细胞质TIR结构域二聚化,启动独特的反应。IL-1Ra:是IL-1α/β的内源性抑制剂,与IL-1R1的结合亲和力高于IL-1α和IL-1β,可阻止IL-1R3的招募,抑制IL-1信号转导,从而发挥抗炎作用,还具有抗凋亡功能。图5 IL-1及其受体IL-1的生理功能及信号通路1IL-1的生理功能和免疫调节作用免疫细胞调节:IL-1作用于多种免疫细胞(如中性粒细胞、T细胞、B细胞等),可刺激T细胞和B细胞的活化和增殖,增强巨噬细胞的吞噬能力。在病原体入侵时充当“警报信号”,吸引免疫细胞迁移至感染部位。因此,IL-1信号的失调可能导致自身免疫疾病。图6 IL-1调节免疫细胞维持上皮屏障:在多种上皮细胞中,IL-1参与维持屏障功能。在皮肤中,角质形成细胞分泌的IL-1可在受伤后被激活,参与免疫细胞招募;在胃肠道,IL-1对胃酸分泌、黏液分泌等有调节作用,同时在肠道炎症和肿瘤发生中起一定作用;在呼吸道,IL-1调节黏液分泌和气道表面液体代谢,促进肺泡上皮细胞再生;在内皮细胞,IL-1参与炎症反应、凝血和血管生成等过程。促进炎症反应:IL-1通过诱导其他炎症因子(如TNF-α、IL-6)和趋化因子(如CXCL8/IL-8)的产生,增加毛细血管的通透性,使免疫细胞更容易渗出血管并到达感染部位,促进炎症反应,引发发热、T细胞激活和抗病原体等反应。图7 IL-1调节多种维持体内平衡的细胞2IL-1的信号传导IL-1R1对IL-1的亲和力高于IL-1R2,是IL-1相关信号通路的主要介导者。IL-1通过与IL-1R1和IL-1R3结合形成异源三聚体,进而激活NFκB、MAPK等信号通路,启动促炎功能。图8 IL-1R组分在IL-1信号转导中的作用受体亲和力受多种因素影响,如遗传突变、可变剪接、翻译后修饰、调节蛋白以及辅助因子和共价修饰等。不同的亲和力状态会影响细胞内信号通路的激活,进而调节炎症和免疫反应。图9 IL-1受体亲和力和信号传导IL-6在疾病中的作用机制1IL-1在肿瘤中的作用诱导癌变:慢性炎症是癌变的标志之一,IL-1在其中发挥重要作用。IL-1已被证明在多种类型的肿瘤中上调,包括乳腺癌、结肠癌、头颈部癌、肺癌、胰腺癌和黑色素瘤。IL-1可诱导免疫、上皮和癌前细胞产生DNA损伤分子,增加突变积累,促进肿瘤发生,其对癌变的影响取决于细胞因子网络的调控。此外,IL-1水平高的患者通常预后较差。调节肿瘤微环境:肿瘤微环境中的炎症可介导多种细胞间的相互作用,促进肿瘤细胞的存活、增殖和转移。IL-1作为重要的炎症调节因子,可由肿瘤细胞、髓样细胞等多种细胞产生,通过激活相关信号通路,促进血管生成、调节免疫细胞功能,为肿瘤细胞营造有利的生长环境。例如,IL-1α可通过VEGFR-2途径诱导血管内皮生长因子(VEGF)的合成和分泌,促进血管生成,为肿瘤的生长和转移提供必要条件;IL-1β可诱导巨噬细胞趋化,使其在肿瘤微环境中聚集,促进肿瘤进展。影响免疫细胞功能:IL-1对不同免疫细胞的功能产生不同影响,从而影响肿瘤的免疫逃逸和发展,在多种癌症中,抑制IL-1R信号可减少肿瘤转移。在髓样细胞方面,IL-1β可促进髓源性抑制细胞(MDSCs)的积累,MDSCs能抑制T细胞的激活,帮助肿瘤细胞逃避机体的免疫监视;在T淋巴细胞方面,IL-1对不同亚型的T细胞免疫反应影响各异,在某些情况下可促进Th2、Th17细胞的分化和扩增,抑制Th1细胞极化和细胞毒性CD8+T细胞的激活,导致免疫抑制,有利于肿瘤细胞的生长和转移。在特定条件下,IL-1也可激活抗肿瘤的Th1细胞和细胞毒性CD8+T细胞,发挥抗肿瘤作用。参与肿瘤细胞的耐药机制:IL-1信号通路可能与受体酪氨酸激酶通路协同作用,使癌细胞产生耐药性。在头颈部鳞状细胞癌、非小细胞肺癌、黑色素瘤和结直肠癌等癌症中,IL-1的产生增加与对EGFR阻断剂、放疗和BRAF抑制剂等治疗的耐药性有关。IL-1是衰老相关分泌表型(SASP)的上游调节因子,可促进癌症干细胞的干性和耐药性。图10 IL-1在肿瘤进展中的作用示意图2IL-1在自身免疫疾病中的作用异常的IL-1信号可导致自身免疫疾病,通过放大T细胞反应、破坏Tregs的稳定性和自身耐受性以及作用于非免疫细胞等机制,参与多种自身免疫疾病的病理过程。在实验性自身免疫性脑脊髓炎(EAE)和胶原诱导的关节炎等疾病中,IL-1可刺激IL-17的产生,加重病情。IL-1还可使Tregs的Foxp3表达降低,使其转化为产生IFN-γ和IL-17的效应T细胞,破坏自身耐受性。此外,IL-1在1型和2型糖尿病、类风湿关节炎、系统性硬化症等疾病中,通过影响非免疫细胞的功能,导致组织损伤和疾病进展。3IL-1在伤口愈合和血栓形成中的作用皮肤受伤时,IL-1参与炎症反应和免疫细胞招募,并促进成纤维细胞增殖和胶原蛋白合成,加速伤口愈合。此外,IL-1还可调节基质金属蛋白酶(MMPs)的活性,参与组织重塑,但过度的IL-1会导致慢性伤口不愈合。在血栓形成方面,过多的IL-1信号会促进血栓形成,抑制IL-1可减少相关疾病中的血栓事件。以IL-1/IL-1R通路为靶点的治疗策略IL-1/IL-1R复合物轴的异常调节与多种疾病的发病机制相关,针对IL-1的治疗在癌症治疗中显示出一定的潜力。目前已开发出多种靶向IL-1α、IL-1β或IL-1R1的治疗策略。如阿那白滞素(Anakinra)、利纳西普(Rilonacept)、卡那单抗(Canakinumab)等已获批用于治疗炎症性疾病,还有一些处于研发阶段的药物,如Bermekimab、AMG108等。此外,多项临床试验正在开展,探索抗IL-1治疗与其他药物联合使用的疗效。表1 过去十年中开发的靶向IL-1通路的药物IL-1在特定疾病类型中的作用1自身炎症性疾病自身炎症性疾病(AIDs)是一类罕见且异质性的疾病,由先天免疫反应失调引起,多在儿童早期发病,其发病机制包括炎性小体功能失调、激活机制异常及调节途径缺陷等。目前已发现30多种基因定义的自身炎症性疾病,多与IL-1途径直接或间接相关。IL-1介导自身炎症的临床特征:IL-1介导的自身炎症性疾病的主要临床特征包括发热,以及episodic或慢性的全身和/或组织炎症。常见受累部位有皮肤和肌肉骨骼系统,部分疾病还会累及浆膜、中枢神经系统和结膜等特定部位。患者常伴有疲劳或不适,实验室检查通常显示急性期标志物升高和血液、组织中的中性粒细胞增多。IL-1驱动的单基因/多基因自身炎症性疾病:单基因自身炎症性疾病由炎症控制相关单基因突变引起,可导致炎性小体激活和IL-1释放。多基因自身炎症性疾病(如慢性复发性多灶性骨髓炎、化脓性汗腺炎谱系疾病等)具有多种遗传病因,与IL-1介导的疾病途径相关,对IL-1阻断治疗有部分反应。表2 IL-1驱动的单基因自身炎症性疾病总结表3 IL-1作用的多基因自身炎症性疾病总结自身炎症性疾病的治疗:秋水仙碱是早期治疗IL-1介导疾病的药物,IL-1R拮抗剂阿那白滞素、重组IL-1R利纳西普和人单克隆抗体卡那单抗等IL-1靶向疗法相继获批,它们安全有效,但存在个体差异和局限性。当前趋势是联合蛋白靶点或开发小分子抑制剂,如针对NLRP3、半胱天冬酶1等的抑制剂,以提高治疗效果。2心血管疾病动脉粥样硬化:IL-1参与动脉粥样硬化斑块的形成、发展和破裂,通过影响内皮细胞功能、诱导炎症反应和促进血栓形成等发挥作用。NLRP3炎性小体与动脉粥样硬化相关,胆固醇晶体可激活该炎性小体,促进IL-1β释放。临床研究如CANTOS试验表明,阻断IL-1β可降低心血管事件风险。图11 IL-1/炎性小体和动脉粥样硬化血栓形成急性心肌梗死(AMI):AMI时,缺血再灌注损伤导致细胞死亡,释放DAMPs,激活NLRP3炎性小体,引发炎症反应,导致心肌细胞死亡和心脏功能受损。抑制NLRP3炎性小体或IL-1活性可减小梗死面积,改善心脏功能。临床研究显示,IL-1阻断剂阿那白滞素可降低AMI患者发生心力衰竭的风险。心力衰竭(HF):炎症促进HF的发生发展,IL-1可直接影响心脏收缩功能,导致心肌收缩和舒张功能下降。IL-1阻断剂治疗HF患者可改善心肺功能和生活质量,降低HF住院率。不同类型的HF患者对IL-1阻断剂的反应有所差异。图12 IL-1和AMI和心力衰竭中的炎性小体炎症性心脏病:在心肌炎、心脏结节病和心包炎等炎症性心脏病中,NLRP3炎性小体和IL-1均发挥重要作用。例如,在心肌炎中,抑制NLRP3炎性小体或IL-1可改善病情;在心包炎中,秋水仙碱和阿那白滞素等治疗有效。图13 NLRP3炎性小体形成的示意图 3附上IL-1/IL-1R的氨基酸序列IL-1α:MAKVPDMFEDLKNCYSENEEDSSSIDHLSLNQKSFYHVSYGPLHEGCMDQSVSLSISETSKTSKLTFKESMVVVATNGKVLKKRRLSLSQSITDDDLEAIANDSEEEIIKPRSAPFSFLSNVKYNFMRIIKYEFILNDALNQSIIRANDQYLTAAALHNLDEAVKFDMGAYKSSKDDAKITVILRISKTQLYVTAQDEDQPVLLKEMPEIPKTITGSETNLLFFWETHGTKNYFTSVAHPNLFIATKQDYWVCLAGGPPSITDFQILENQAIL-1β:MAEVPELASEMMAYYSGNEDDLFFEADGPKQMKCSFQDLDLCPLDGGIQLRISDHHYSKGFRQAASVVVAMDKLRKMLVPCPQTFQENDLSTFFPFIFEEEPIFFDTWDNEAYVHDAPVRSLNCTLRDSQQKSLVMSGPYELKALHLQGQDMEQQVVFSMSFVQGEESNDKIPVALGLKEKNLYLSCVLKDDKPTLQLESVDPKNYPKKKMEKRFVFNKIEINNKLEFESAQFPNWYISTSQAENMPVFLGGTKGGQDITDFTMQFVSSIL-1R1:MKVLLRLICFIALLISSLEADKCKEREEKIILVSSANEIDVRPCPLNPNEHKGTITWYKDDSKTPVSTEQASRIHQHKEKLWFVPAKVEDSGHYYCVVRNSSYCLRIKISAKFVENEPNLCYNAQAIFKQKLPVAGDGGLVCPYMEFFKNENNELPKLQWYKDCKPLLLDNIHFSGVKDRLIVMNVAEKHRGNYTCHASYTYLGKQYPITRVIEFITLEENKPTRPVIVSPANETMEVDLGSQIQLICNVTGQLSDIAYWKWNGSVIDEDDPVLGEDYYSVENPANKRRSTLITVLNISEIESRFYKHPFTCFAKNTHGIDAAYIQLIYPVTNFQKHMIGICVTLTVIIVCSVFIYKIFKIDIVLWYRDSCYDFLPIKASDGKTYDAYILYPKTVGEGSTSDCDIFVFKVLPEVLEKQCGYKLFIYGRDDYVGEDIVEVINENVKKSRRLIIILVRETSGFSWLGGSSEEQIAMYNALVQDGIKVVLLELEKIQDYEKMPESIKFIKQKHGAIRWSGDFTQGPQSAKTRFWKNVRYHMPVQRRSPSSKHQLLSPATKEKLQREAHVPLGExtracellularHelicalCytoplasmic18-336337-356357-569IL-1R2:MLRLYVLVMGVSAFTLQPAAHTGAARSCRFRGRHYKREFRLEGEPVALRCPQVPYWLWASVSPRINLTWHKNDSARTVPGEEETRMWAQDGALWLLPALQEDSGTYVCTTRNASYCDKMSIELRVFENTDAFLPFISYPQILTLSTSGVLVCPDLSEFTRDKTDVKIQWYKDSLLLDKDNEKFLSVRGTTHLLVHDVALEDAGYYRCVLTFAHEGQQYNITRSIELRIKKKKEETIPVIISPLKTISASLGSRLTIPCKVFLGTGTPLTTMLWWTANDTHIESAYPGGRVTEGPRQEYSENNENYIEVPLIFDPVTREDLHMDFKCVVHNTLSFQTLRTTVKEASSTFSWGIVLAPLSLAFLVLGGIWMHRRCKHRTGKADGLTVLWPHHQDFQSYPKExtracellularHelicalCytoplasmic14-343344-369370-398抗体发现服务 & 产品01羊驼免疫&骆驼免疫—自建现代化养殖农场02万亿级天然抗体库产品—轻松DIY科研抗体03配套产品—助您轻松搭建基因工程抗体平台关于仁域生物成都仁域生物成立于2019年1月,是一家专注基因工程抗体技术和天然抗体库开发的公司,拥有优化的噬菌体展示抗体库技术和现代化的骆驼/羊驼养殖免疫基地。可为客户提供14天、100%成功率的先导抗体分子发现服务,彻底解决传统抗体定制的周期长、失败率高、成本高三大难题。目前已经成功完成300+靶点抗体筛选项目!protocol 获取 / 产品咨询邮箱|find@renyubio.com电话|19136178673地址|成都市经开区科技产业孵化园关注我们,持续更新相关内容参考文献Zhukova JV, Lopatnikova JA, Alshevskaya AA, Sennikov SV. Molecular mechanisms of regulation of IL-1 and its receptors. Cytokine Growth Factor Rev. 2024 Dec;80:59-71. Ubhe A. IL-1 receptor antagonist: etiological and drug delivery systems overview. Inflamm Res. 2024 Dec;73(12):2231-2247. Caiado F, Manz MG. IL-1 in aging and pathologies of hematopoietic stem cells. Blood. 2024 Jul 25;144(4):368-377. Kim DH, Lee WW. IL-1 Receptor Dynamics in Immune Cells: Orchestrating Immune Precision and Balance. Immune Netw. 2024 May 29;24(3):e21. Broderick L, Hoffman HM. IL-1 and autoinflammatory disease: biology, pathogenesis and therapeutic targeting. Nat Rev Rheumatol. 2022 Aug;18(8):448-463.Pretre V, Papadopoulos D, Regard J, Pelletier M, Woo J. Interleukin-1 (IL-1) and the inflammasome in cancer. Cytokine. 2022 May;153:155850.Malcova H, Strizova Z, Milota T, Striz I, Sediva A, Cebecauerova D, Horvath R. IL-1 Inhibitors in the Treatment of Monogenic Periodic Fever Syndromes: From the Past to the Future Perspectives. Front Immunol. 2021 Feb 1;11:619257.Pyrillou K, Burzynski LC, Clarke MCH. Alternative Pathways of IL-1 Activation, and Its Role in Health and Disease. Front Immunol. 2020 Dec 18;11:613170.Gelfo V, Romaniello D, Mazzeschi M, Sgarzi M, Grilli G, Morselli A, Manzan B, Rihawi K, Lauriola M. Roles of IL-1 in Cancer: From Tumor Progression to Resistance to Targeted Therapies. Int J Mol Sci. 2020 Aug 20;21(17):6009.Abbate A, Toldo S, Marchetti C, Kron J, Van Tassell BW, Dinarello CA. Interleukin-1 and the Inflammasome as Therapeutic Targets in Cardiovascular Disease. Circ Res. 2020 Apr 24;126(9):1260-1280.
临床结果临床研究
2025-04-05
·医脉通
医疗无小事,诊疗有风险,且行且珍惜。来源 | 医脉通作者 | 奔走的急诊老刘孕妇术后发生猝死,最终死因出乎意料!最近看到一个个案病例,与大家共享。病例回顾患者女性,29岁,停经36周,阑尾切除术后3天入院。既往无吸烟、糖尿病、高脂血症、高血压病等危险因素,无结节病或主动脉疾病的证据,无猝死家族史。入院时PE:T 37.0℃,P 96次/分,R 21次/分,BP 120/70mmHg;体格检查未见明显异常。入院3小时后诉胸闷,医生查体未见明显异常,予以吸氧及半卧位处理后胸闷好转。第二天早晨(入院10小时后)查房仍未见异常。实验室检查:血常规:Hb 99g/L、RBC 3.78×1012/L、WBC 12.0×109/L;凝血功能:PT 11.3s、APTT 29.0s、TT 11.0s、FIB 4.30g/L、INR 0.94;生化:电解质,肝功能正常。外科会诊查看阑尾手术恢复良好。上午9:00(入院12小时)患者突然晕厥,呻吟、面色苍白、口唇青紫、流涎,立即予以平卧、吸氧、心电监护,听心音不清。立即予以胸外按压,气管插管,肾上腺素等抢救药物应用,最终抢救无效死亡;10:30放弃抢救。患者死后,家属大闹医院,对死因提出质疑向医院索赔80万,医院拒绝,最终医患双方达成尸检协议。医院发现生化检验结果异常:AST:283u/L、LDH:583u/L、CK:2512u/L(25-192u/L)、CK-MB:157u/L(0-24u/L )。将原血清送往上级医院复查心肌酶谱还是明显增高。尸检结果显示:心包大量积血致心包急性填塞;心脏破裂;前降支自发性夹层。尸检死亡原因:由于左冠状动脉前降支外膜下管壁滋养血管破裂,致管壁中膜与外膜间血肿形成,导致真性血管腔高度受压,管腔狭窄,闭塞,即自发性冠状动脉夹层,从而引起此血管供养区域的心肌发生急性心肌梗死,心室游离壁破裂,心包填塞而死亡。该病极罕见,全球报道百余例,国内仅见个例报道。家属接受此结论,此医疗纠纷就此结束。自发性冠状动脉夹层是一种什么疾病?自发性冠状动脉夹层(SCAD)是指突然出现的冠状动脉壁内假腔,对真腔产生压迫,引起冠脉血流减少导致的病症。1931年学者Pretty HC首次描述了自发性冠状动脉夹层(SCAD),这些病人大多数是30岁左右妇女,至少有三分之一是妊娠或妊娠后,前降支最常受影响。SCAD的真实发病率未知,因为很多病例并未得到诊断。有研究发现,年轻女性的SCAD发病率较高,妊娠和围产期病例占少数,大约为10%。SCAD不应再被视为围产期病症,但妊娠期心梗中有21%~27%是SCAD,产后冠脉事件中有50%是SCAD。既往报告的SCAD病例涉及的人群范围广泛,SCAD是年轻和中年女性ACS、妊娠期或分娩后患者心肌梗死的一种常见原因。SCAD的高危原因包括高血压病、冠状动脉痉挛、主动脉根部夹层、纤维肌肉增生、马凡氏综合征和结缔组织疾病和系统性红斑狼疮,但在一些情况下为特发性。使用口服避孕药、剧烈运动、性交、孤立纤维肌肉发育不良、胸部钝创伤、吸毒(可卡因)、免疫抑制(环孢素)、炎症性疾病等会增加该疾病的发生。SCAD存在很强的女性倾向性和妊娠相关性,提示女性激素在SCAD发病机制中可能存在作用,但其机制仍不清楚。SCAD临床表现为急性冠脉综合征,胸痛是最常见的症状(60%~90%),少数患者有心律失常(2.8%~10%)。其他症状还包括恶心和呕吐23.4%,出汗20.9%,呼吸困难19.3%,背痛12.2%等。简单来说,典型的SCAD表现为青年女性,无传统的动脉粥样硬化危险因素,临床症状与动脉粥样硬化性急性冠脉综合征无明显差别。所以,如果一个没有危险因素的年轻女性因为急性心梗就诊,那么SCAD的可能性很大。尽管SCAD并不常见,但对该病及其血管造影表现的关注程度已有所提高。准确和快速的诊断是至关重要的,因为该病引起的急性心肌梗死的处理与动脉粥样硬化性心肌梗死有很大的不同。一般认为,SCAD急性期治疗禁止溶栓,采用抗血小板治疗以及治疗时间仍然存在争议。他汀类药物仅用于存在常规适应证的患者,而不常规用于SCAD。SCAD事件急性期胸痛和复发性胸痛可使用血管扩张药物,例如硝酸酯类和钙通道阻滞剂。对于血流动力学稳定、病变血管远端血流尚可、无明显持续缺血的病例,保守治疗通常是有利的。少数采取保守治疗的患者随后可能需要进行血运重建。通过介入治疗恢复血运重建存在很大的挑战性,也有成功的案例,但是并发症发生率较高,手术成功率仅为57%。当心!妊娠期出现的任何不适症状都不容忽视对于本周病例患者死因疾病有了一些了解后,回头来看看从个案报道上反映出的一些细节。患者是因为什么主诉而入院没有提到,只是说孕36周阑尾炎术后3天。但是,入院后3小时患者出现了胸闷症状。一说到胸闷症状,首先考虑的一定是排除心肺疾病,特别是急性心血管疾病。值班医生在“查体”后没有发现异常体征,没有完善相关辅助检查,如心电图、心肌酶、血气等,只是给患者吸氧处理。患者在入院时并没有给予完善辅助检查,在入院后3小时出现异常症状后仍旧没有及时检查,血常规、凝血象和部分生化结果是入院后10小时回报的。而在入院后12小时患者发生心源性猝死后,心肌酶结果才被发现。从发生心肌梗死到心肌坏死导致心脏破裂,其中会有一个过程。如果这几个小时之中进行常规心电图检查,就可能发现异常。如果及时进行心肌酶检查,就可能早期诊断急性心肌梗死。如果早期诊断,是不是有机会通过严格的保守治疗,或探讨介入治疗对患者救治。面对胸闷症状,医生需要根据诊疗常规进行体格检查,完善辅助检查,对病情进行评估或明确诊断,这是医方应尽的诊疗义务。通常需要首要排除的就是严重的心血管疾病。每次在医疗损害责任纠纷案件的鉴定过程中,鉴定专家会对医方是否针对患者症状或病情变化完善辅助检查(诊疗义务),谨慎地进行观察评估(谨慎注意义务),采取合理治疗方案(诊疗义务),与患方交代病情、沟通治疗方案(告知义务)进行评估。如果存在“不到位”的情况,就会被视为医方过错,存在过错就可能与患者损害后果相关,存在相关性就需要承担赔偿责任。妊娠期需要警惕的心血管疾病如果一名有“三高”危险因素的老年女性出现胸闷,医生很大可能会给患者进行心电图检查,为什么患者出现胸闷会被临床医生忽视?最可能的原因就是医生没有认为患者存在心血管疾病发生的可能。一个没有危险因素的年轻女性,通常医生不会与急性心肌梗死联系起来。但实际情况是,妊娠期新发心血管疾病的孕妇并不罕见,并且一旦发病未及时救治,最终预后通常很不好。妊娠期高血压是临床上孕妇最常新发的心血管疾病,由于血压升高可以导致子痫,引发心力衰竭。围产期心肌病的发生通常没有明确的原因,可以导致左心功能不全、心律失常、血栓栓塞。妊娠相关主动脉夹层常会导致孕妇围产期死亡。还有,静脉血栓栓塞症和冠状动脉疾病常发生在有危险因素的患者上。女性在怀孕后通常会出现各种不适症状,经常会头晕、乏力、心悸、胸闷或者各种疼痛。同时,大部分孕妇都是年轻女性,既往健康并且没有心血管相关危险因素。这些都成为医生会忽视这类患者异常症状的原因。所以,疾病诊断过程会延误,甚至被误诊。医生们总是会抱怨鉴定专家以结果推过程,是在用“上帝”视角去审视诊疗行为。但是,有多少医生会意识到,在诊疗患者的时候经常会“想当然”地去诊断,“凭感觉”去处置。还是那句话,医疗无小事,诊疗有风险,且行且珍惜。栏目顾问律师:梁雨律师,毕业于中国政法大学,北京觅理律师事务所主任,合伙人。梁雨律师团队专注于民商事法律诉讼、公司企业法律顾问,业务领域涵盖股权投资、医疗纠纷、知识产权等,其丰富的执业经验切实维护了委托人的合法权益,为客户提供了有效的法律服务。本文事件来自于:DrKing道金医学。责编|阿泰封面图来源|视觉中国医生男朋友一天不回消息,打电话就说在忙,他是不是出轨了?“现在好好工作,将来有的是时间玩!”信了这话的医生,这辈子要遭老罪了医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。☟戳这里,更有料!
分析
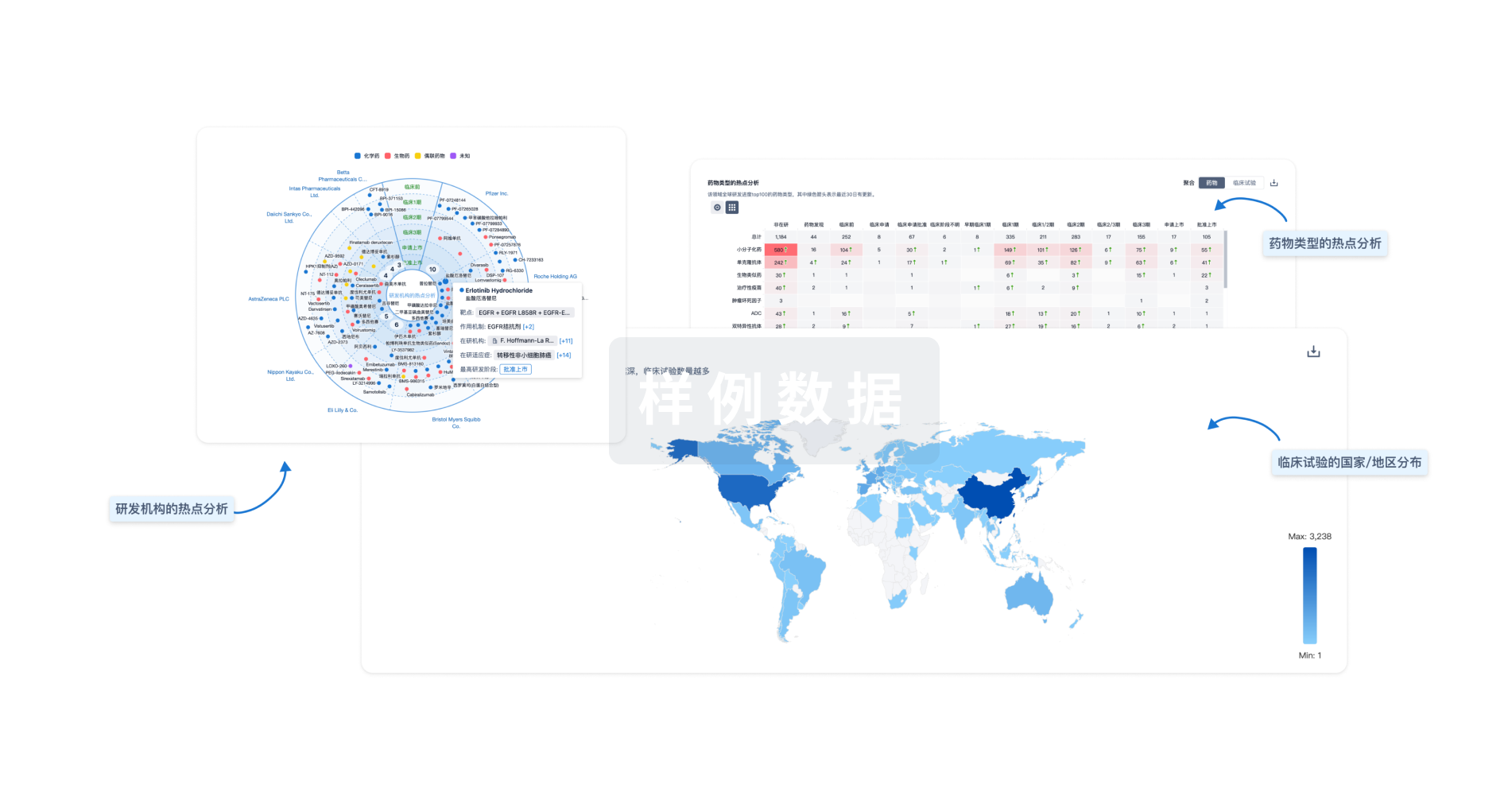
对领域进行一次全面的分析。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用




