礼来GIPR x GLP-1R激动剂替尔泊肽新3期结果发表NEJM,显著延缓心衰恶化
日前,礼来公司公布了3期临床试验SUMMIT的详细结果。研究显示,其重磅疗法tirzepatide(替尔泊肽)显著降低了伴有射血分数保留型心力衰竭(HFpEF)和肥胖的成年患者出现恶化心衰事件的风险。同时患者的心衰症状和身体活动受限情况获得改善。这些结果已发表于《新英格兰医学杂志》,并在2024年美国心脏协会(AHA)科学年会上进行报告。
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂,曾在大型 III 期临床中头对头击败司美格鲁肽,也是首个且目前唯一获得全球批准的GIPR x GLP-1R受体激动剂。2022年5月,该药获得美国FDA批准(商品名:Mounjaro),用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。减肥适应症方面,礼来在美国进行了4项三期临床,全部取得成功。2023年11月9日, Zepbound(tirzepatide)获美国FDA批准,用以使肥胖或超重成年患者减轻体重并保持体重稳定。这些患者患有体重相关共病,包含高血压、血脂异常、2型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病。
 礼来公司已经向全球监管机构递交申请,寻求使用tirzepatide治疗这一患者群体。Tirzepatide在复合终点评估中相比安慰剂显示出心衰事件风险降低38%,并显著减少心衰住院风险56%。此外,与安慰剂组的15分改善相比,tirzepatide治疗组的患者在堪萨斯城心肌病问卷临床总结评分(KCCQ-CSS)中取得了近25分的提升,该问卷用于评估心衰相关症状和身体活动受限情况。在所有关键性次要终点中,tirzepatide治疗组均表现出显著改善。
礼来公司已经向全球监管机构递交申请,寻求使用tirzepatide治疗这一患者群体。Tirzepatide在复合终点评估中相比安慰剂显示出心衰事件风险降低38%,并显著减少心衰住院风险56%。此外,与安慰剂组的15分改善相比,tirzepatide治疗组的患者在堪萨斯城心肌病问卷临床总结评分(KCCQ-CSS)中取得了近25分的提升,该问卷用于评估心衰相关症状和身体活动受限情况。在所有关键性次要终点中,tirzepatide治疗组均表现出显著改善。
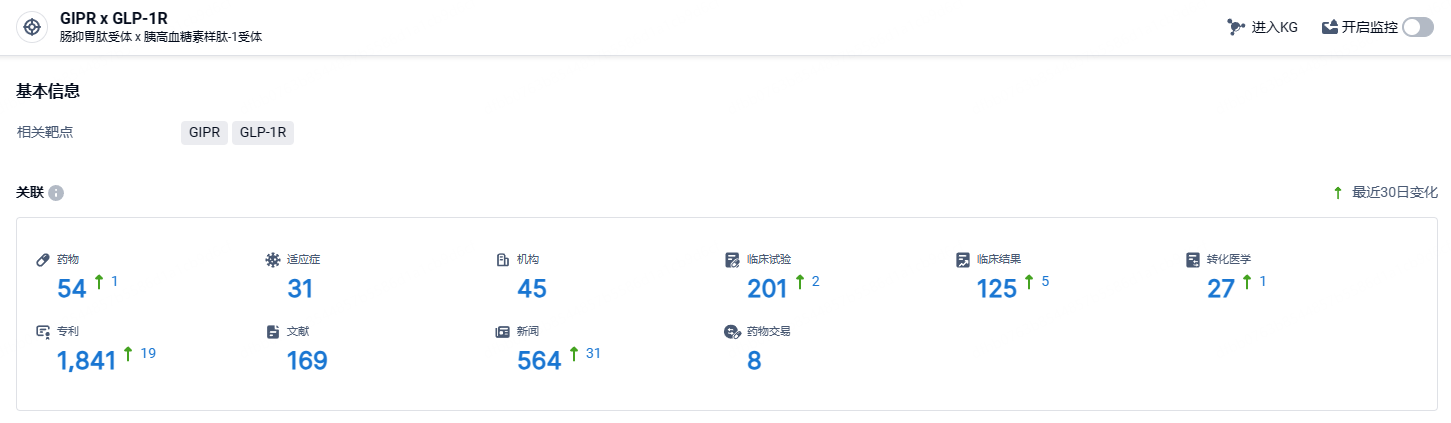
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GIPR x GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月21日,GIPR x GLP-1R靶点共有在研药物54个,包含的适应症有31种,在研机构45家,涉及相关的临床试验201件,专利多达1841件……tirzepatide临床试验数据优秀,在降糖和减重领域具有非常大的市场潜力,该药有望成为破百亿美元销售的重磅品种。