塞利尼索——靶向XPO1的小分子化药
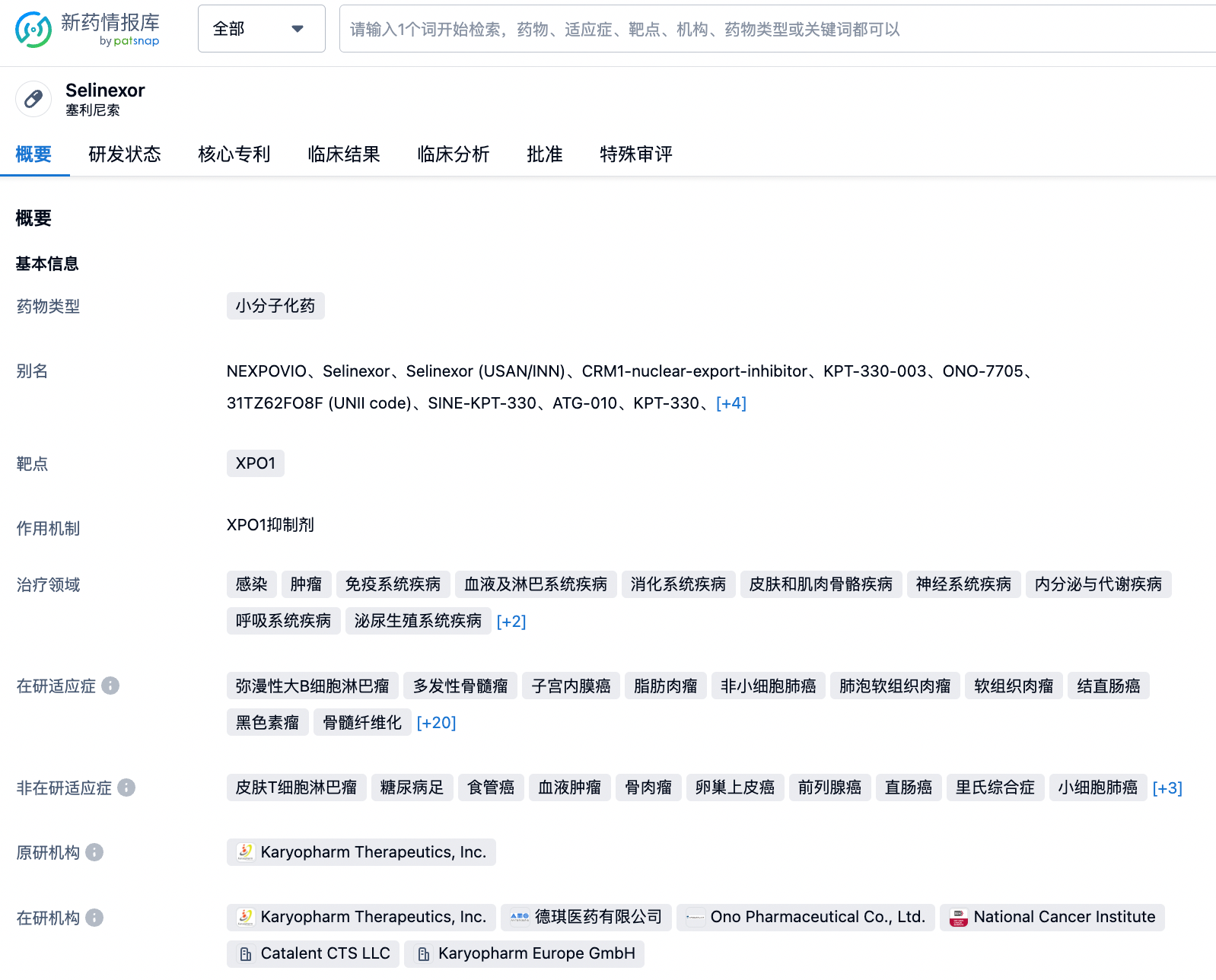
塞利尼索,英文名称Selinexor,商品名XPOVIO,是由Karyopharm Therapeutics, Inc.开发的一款靶向XPO1的小分子化药。该药物最早于2019年07月03日在美国获批,用于治疗多发性骨髓瘤。之后陆续在以色列、欧盟、英国、韩国等多个国家/地区获批。主要用于肿瘤领域,涉及三四十个细分瘤种,其中多个瘤种已停止开发。2023年07月17日,针对原发性骨髓纤维化、原发性血小板增多症后骨髓纤维化、真性红细胞增多症后骨髓纤维化三个适应症,美国FDA将Selinexor纳入快速通道程序。
研发状态
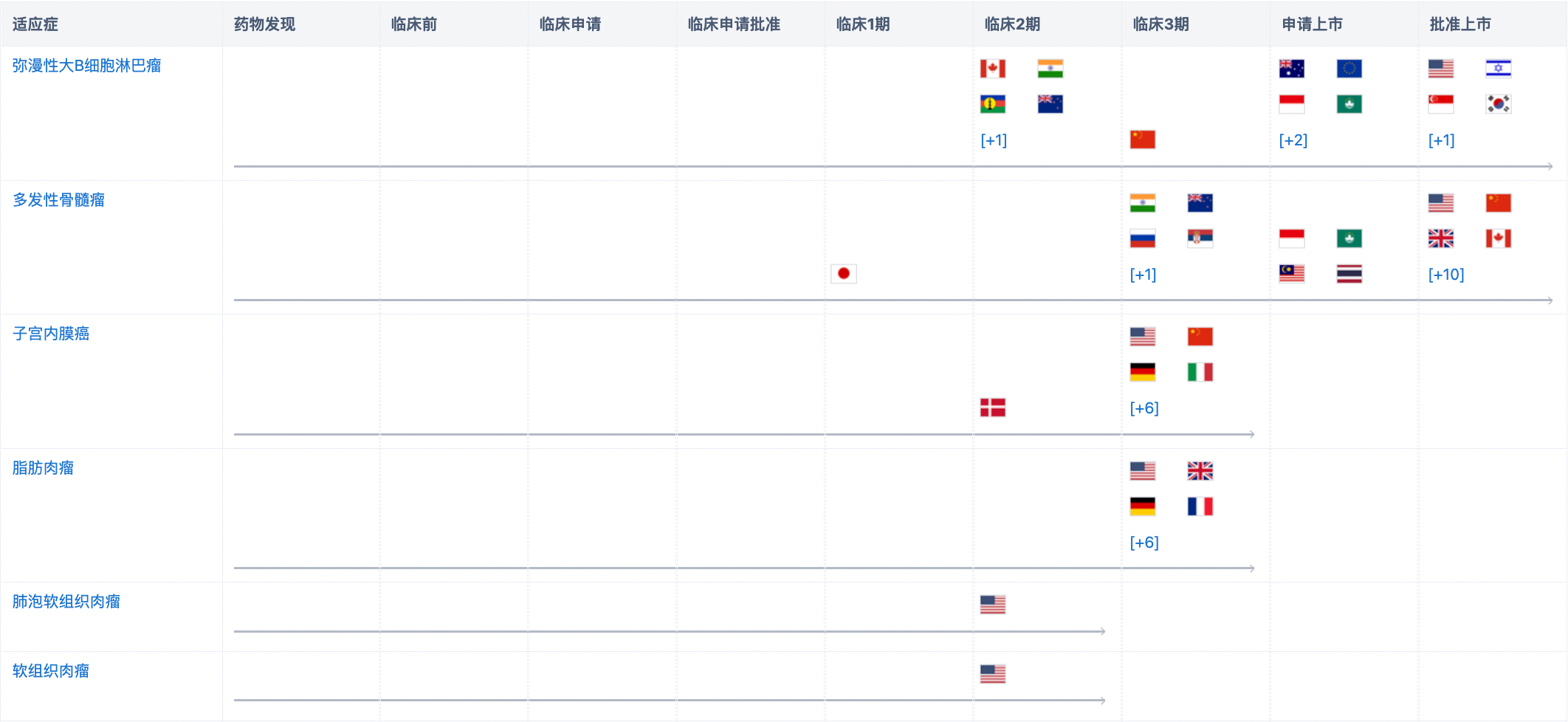
经查询“智慧芽新药情报库”,弥漫性大B细胞淋巴瘤已在美国、以色列、新加坡、韩国、中国台湾获批;多发性骨髓瘤在中国、美国等十余个国家获批;子宫内膜癌在中国、美国、德国等多国进入临床3期阶段;除此之外,开发的适应症还包括脂肪肉瘤、非小细胞肺癌、肺泡软组织肉瘤、软组织肉瘤、结直肠癌、黑色素瘤、骨髓纤维化、新型冠状病毒感染、原发性血小板增多症后骨髓纤维化、真性红细胞增多症后骨髓纤维化、原发性骨髓纤维化、胸腺瘤、胸腺上皮肿瘤、外周T细胞淋巴瘤、骨髓增生异常综合征、乳腺癌、卵巢癌、胶质母细胞瘤、急性髓性白血病等等。更多机构信息、管线布局、营收等信息,请点击下方图片链接获取。
Selinexor曾获得十七个特审审评认证,大半为不同适应症的“孤儿药”认证;其次为“快速通道(美国)”,除此次的三个适应症外,还包括2019年获得认证的多发性骨髓瘤、2020年获得认证的弥漫性大B细胞淋巴瘤。
XPO1是细胞核内的一种核输出蛋白,参与将大量蛋白质从细胞核运输到细胞质中的过程。XPO1过度表达或突变,增强输出能力,影响细胞增殖等。 Selinexor通过抑制核输出蛋白XPO1,促使肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,并下调细胞浆内多种致癌蛋白水平,诱导肿瘤细胞凋亡、激活糖皮质激素受体(GR)通路。
核心临床试验数据
难治性浆细胞骨髓瘤:在临床2期研究(NCT03589222)中,Selinexor-DVd组的ORR为50.0%。在临床3期研究(NCT03110562)中,Selinexor+Bortezomib+Dexamethasone联合治疗的受试者中,ORR为67.9%,相比之下,仅用Bortezomib和Dexamethasone治疗的ORR为47.2%。
难治性B细胞淋巴瘤:在临床2期研究(NCT05322330)中,Selinexor组的ORR为66.7%。
胶质母细胞瘤:在临床2期研究(NCT04421378)中,Selinexor组的肿瘤生长抑制率(Tumor growth inhibition,TGI)为64.5%,Temozolomide组的TGI为67.2%。
多发性骨髓瘤:在临床3期研究(NCT03110562)中,Bortezomib+Dexamethasone+Selinexor组的mPFS为16.6个月,相比之下,不含Selinexor的Bortezomib+Dexamethasone组mPFS为9.2个月。
竞争格局
经查询,截止2023年08月05日,全球只有15种XPO1药物,且Selinexor是唯一一款获批的XPO1靶向药物,同公司开发的另一款药物Eltanexor处于临床2期,其余6款在临床1期,5款在临床前,2款已停止开发,所以Selinexor面临的竞争较小。