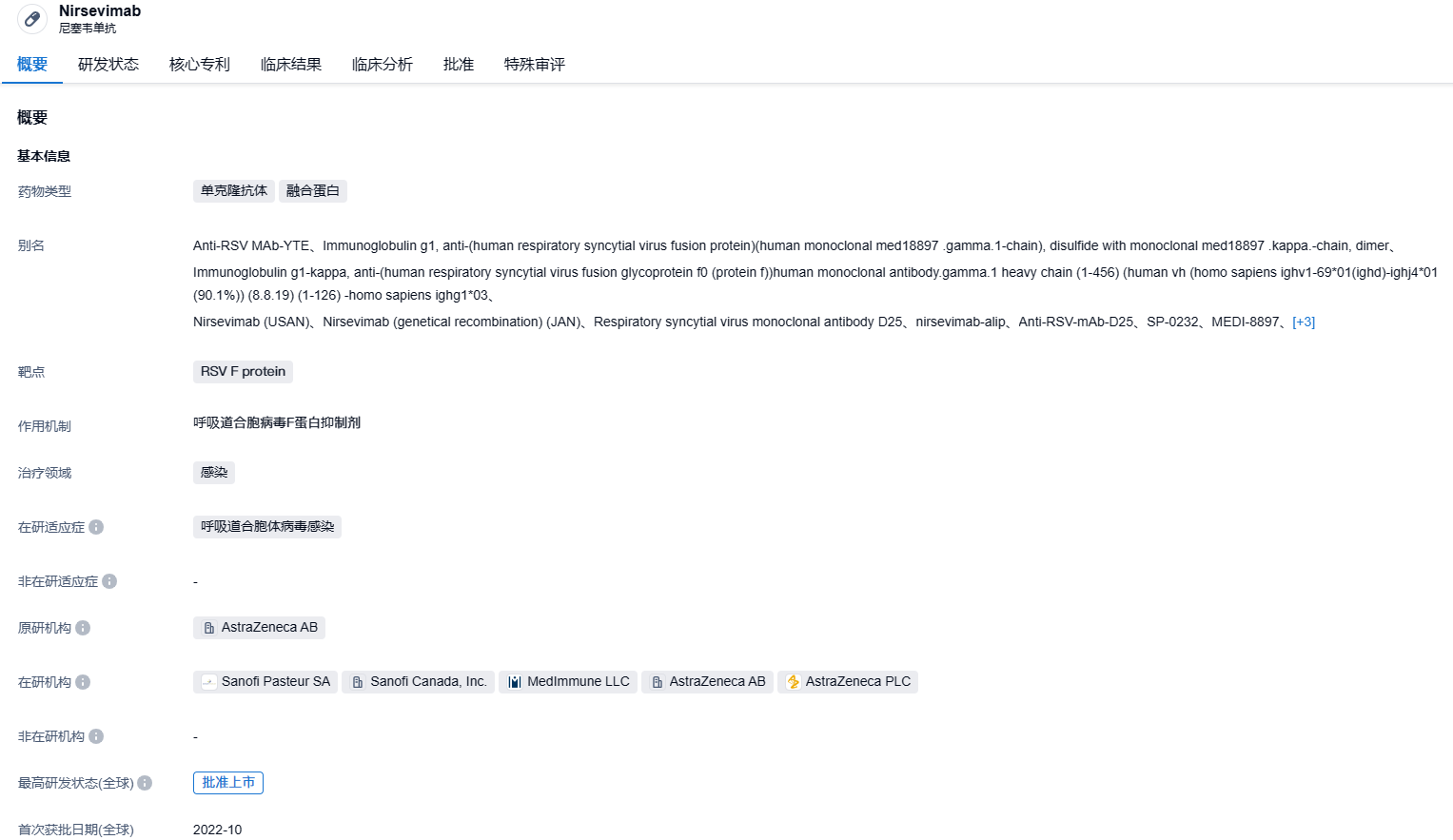
10:0投票结果!赛诺菲/阿斯利康RSV长效抗体nirsevimab获美国CDC一致推荐
近日,美国疾病预防与控制中心(CDC)免疫实践咨询委员会(ACIP)以10:0的投票结果一致推荐赛诺菲/阿斯利康联合开发的Beyfortus(nirsevimab,尼塞韦单抗)用于预防婴儿由RSV引起的下呼吸道疾病;为即将进入或在第一个RSV流行季期间出生的新生儿和8个月以下婴儿提供保护。
nirsevimab是赛诺菲/阿斯利康联合开发的一种针对RSV病毒F蛋白(RSV F protein)融合前构象的长效重组肌内注射中和人源IgG1ĸ单克隆抗体,其Fc结构与的三个氨基酸被替换(YTE突变)以延长其半衰期,因此nirsevimab能在整个RSV季节中维持有效浓度,注射一次即可,体重<5 kg的婴儿单次肌内注射50 mg,体重≥5 kg的婴儿单次肌内注射100 mg。2017年,赛诺菲和AZ达成合作协议,由AZ负责研发和生产,赛诺菲负责商业化和营收记录,两家公司在除美国以外的地区分享利益和营收,在美国的商业收益完全归赛诺菲。2022年10月,nirsevimab在欧盟首次获批,11月在英国获批,2023年2月在日本递交申请,4月在加拿大获批。2023年年5月,nirsevimab也在中国递交申请资料,被CDE纳入优先审评。
nirsevimab此次获得FDA批准是基于多个临床试验结果,包括三个关键的后期临床试验(2b期试验、3期MELODY试验、2/3期MEDLEY试验)。3期MELODY、2/3期MEDLEY和2b期试验的结果表明,单剂注射nirsevimab有助于在婴儿的第一个RSV季节保护婴儿免受RSV疾病的侵害。这些试验涵盖了包括健康足月儿、健康的晚期早产儿(胎龄≥35周)和早产儿(胎龄29-35周),以及有特殊健康状况使其容易患上严重RSV疾病的婴儿在内的所有婴儿人群。
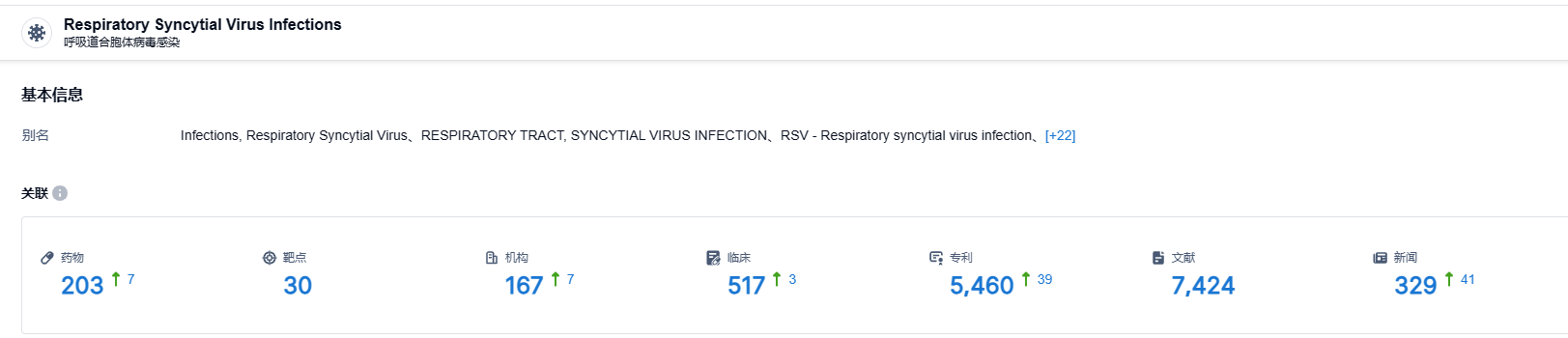
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 RSV F protein 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月8日,RSV F protein 靶点共有在研药物203个,包含的适应症有30种,在研机构167家,涉及相关的临床试验517件,专利多达5460件……nirsevimab具有广阔的市场空间,期待该药后续的表现。