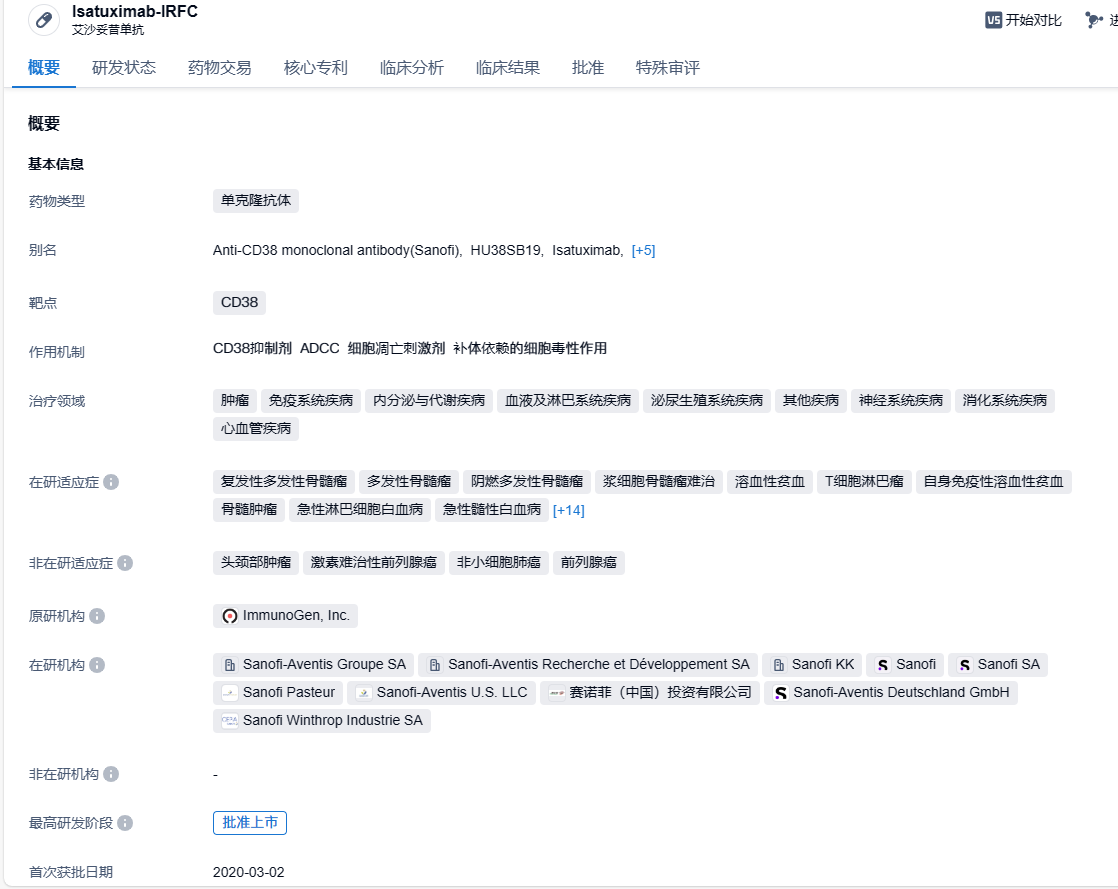
赛诺菲CD38抗体isatuximab获FDA批准,用于一线治疗多发性骨髓瘤
9月24日,赛诺菲宣布,美国FDA已批准抗CD38抗体Sarclisa(isatuximab)与硼替佐米、来那度胺和地塞米松(VRd)联合使用,作为一线治疗方案用于不适合进行自体干细胞移植(ASCT)的新确诊多发性骨髓瘤(NDMM)成人患者。Sarclisa与标准治疗VRd联合使用,与单独使用VRd相比,显著减少了不适合ASCT的NDMM患者的疾病进展或死亡风险(降低40%)。
Isatuximab是一种裸嵌合单克隆抗体,与人体表面抗原CD38上特殊的抗原表位进行选择性结合。可通过多种生物学机制杀伤肿瘤细胞。包括抗体依赖的细胞介导细胞毒性、补体依赖性的细胞毒性、无需交联直接诱发细胞凋亡活性、抑制CD38的酶活性。Isatuximab于2020年3月首次获FDA批准上市,用于联合泊马度胺和地塞米松治疗既往至少接受过2线治疗(包括来那度胺和一种蛋白酶体抑制剂)的复发或难治性多发性骨髓瘤成人患者。2021年3月,Isatuximab获FDA批准扩展新适应症,用于联合卡非佐米和地塞米松用于既往接受过1-3线治疗的复发性或难治性多发性骨髓瘤成人患者。
Sarclisa是美国FDA批准作为与标准治疗联合,用于治疗新确诊多发性骨髓瘤且不适合接受ASCT治疗成年患者的首个CD38靶向疗法。FDA的批准基于最近在2024年美国临床肿瘤学会(ASCO)年会上发布并在《新英格兰医学杂志》上发表的3期临床试验IMROZ的数据。在IMROZ研究中,与VRd治疗然后使用Rd相比,Sarclisa联合VRd然后使用Sarclisa联合Rd达到了无进展生存期(PFS)的主要终点。与对照组相比,Sarclisa组合疗法将患者复发或死亡风险减少40%(HR=0.60;95% CI:0.44-0.81,p=0.0009)。
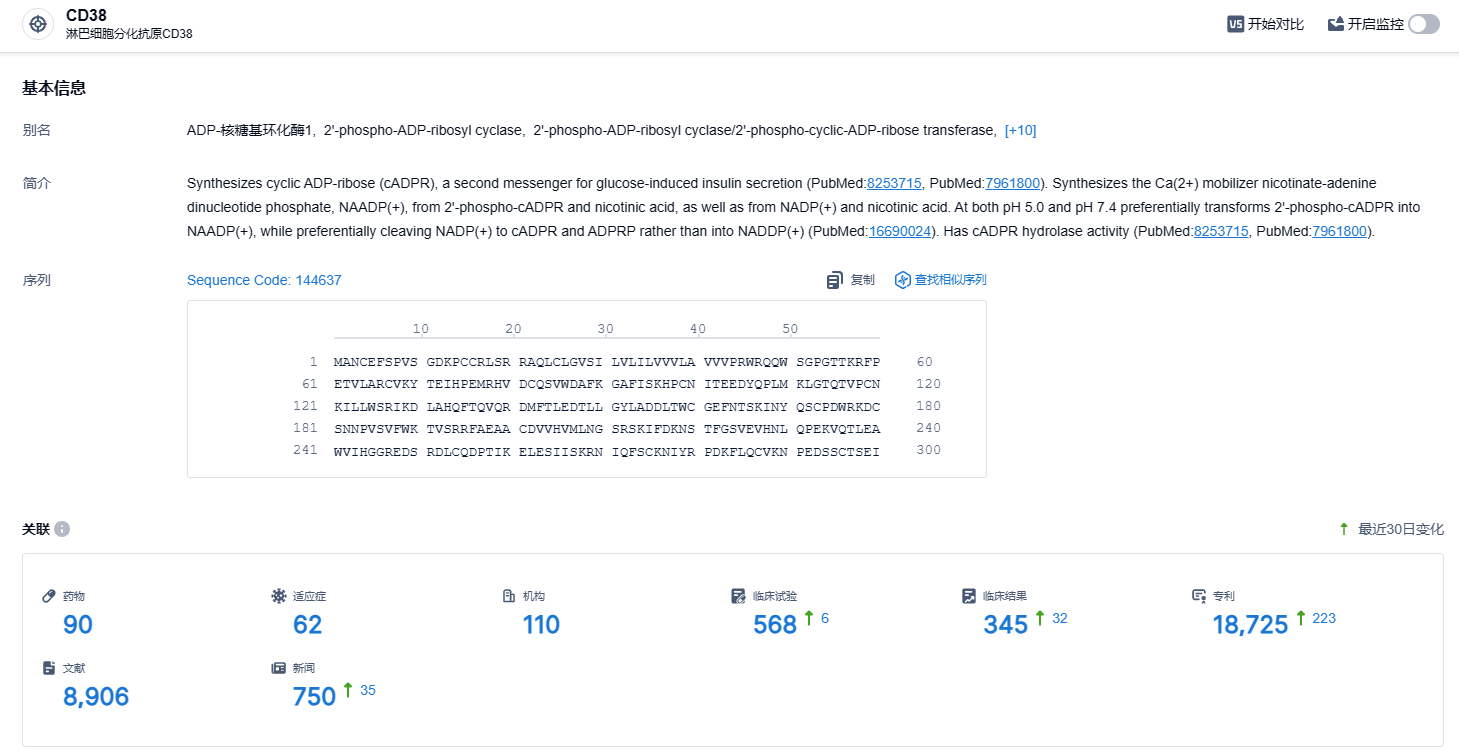
根据智慧芽新药情报库所披露的信息(点击下方卡片直达CD38靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年9月26日,CD38靶点共有在研药物90个,包含的适应症有62种,在研机构110家,涉及相关的临床试验568件,专利多达18725件……目前全球范围内获批的CD38抗体有强生的达雷妥尤单抗(Daratumumab)和赛诺菲的Isatuximab;国内企业中,天境生物/HI-Bio的菲泽妥单抗和尚健生物的SG-301正处于III期临床,康诺亚自主研发的CM313目前正处于II期试验;此外,国内进入临床的还有凯信远达/天石同达、康缘药业、友芝友生物等。期待国产CD38抗体的表现。




