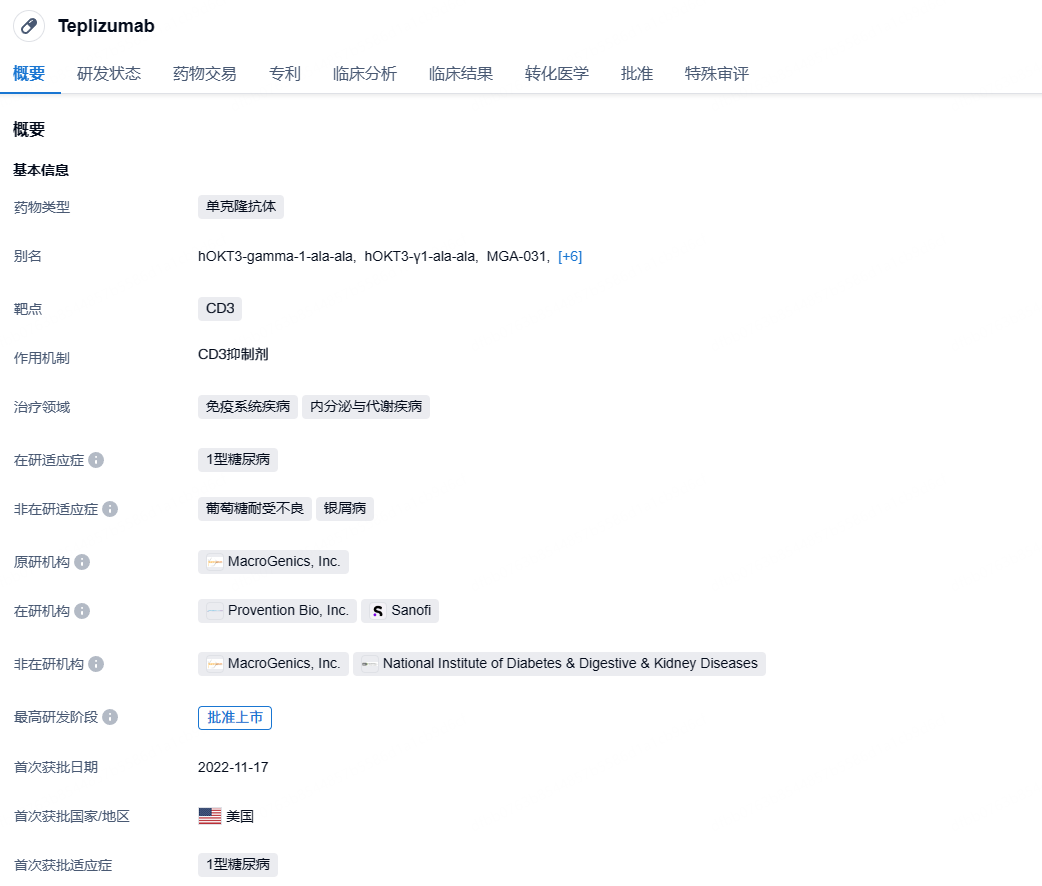
赛诺菲CD3单抗替利珠单抗拟纳入优先审评,延缓1型糖尿病发病!
8月20日,CDE官网显示,赛诺菲的替利珠单抗(teplizumab/PRV-031,美国商品名为Tzield)拟纳入优先审评,用于延缓成人和8岁及以上儿童1型糖尿病患者从2期进展至3期的速度。该产品已在2022年11月获FDA批准上市。
替利珠单抗是MacroGenics开发的一款CD3单抗,通过与效应T细胞表面的CD3结合,抑制T细胞对胰岛β细胞的攻击,从而保护胰岛β细胞不受破坏。替利珠单抗的Fc段经氨基酸修饰后,构成了Fc受体非结合(FNB)区域,可减少其与补体和Fc受体的结合从而降低相关毒性反应。2007年10月,礼来与MacroGenics达成协议,以6.41亿美元的总交易额获得替利珠单抗的开发与商业化权益。不过,礼来在三年后终止了双方的合作。2018年5月,Provention Bio从MacroGenics手中收购了替利珠单抗的所有权益,并将其作为核心产品,公司也基于此募资5600万美元IPO。2022年10月,赛诺菲与Provention Bio达成合作,获得替利珠单抗的美国商业化权益。在替利珠单抗顺利获得FDA批准后,赛诺菲出手29亿美元并购Provention Bio,获得该产品的所有权益。
在一项注册性II期研究中,替利珠单抗显示出了非常不错的延缓1型糖尿病发病效果。结果显示,在76例进展风险高的1型糖尿病2期受试者中,替利珠单抗组受试者确诊为1型糖尿病的时间显著晚于安慰剂组(48.4 vs. 24.4个月,HR=0.41,P=0.006);替利珠单抗组确诊为1型糖尿病的受试者比例也低于安慰剂组(43% vs. 72%)。总而言之,替利珠单抗组的1型糖尿病年诊断率为14.9%,而安慰剂组为35.9%。
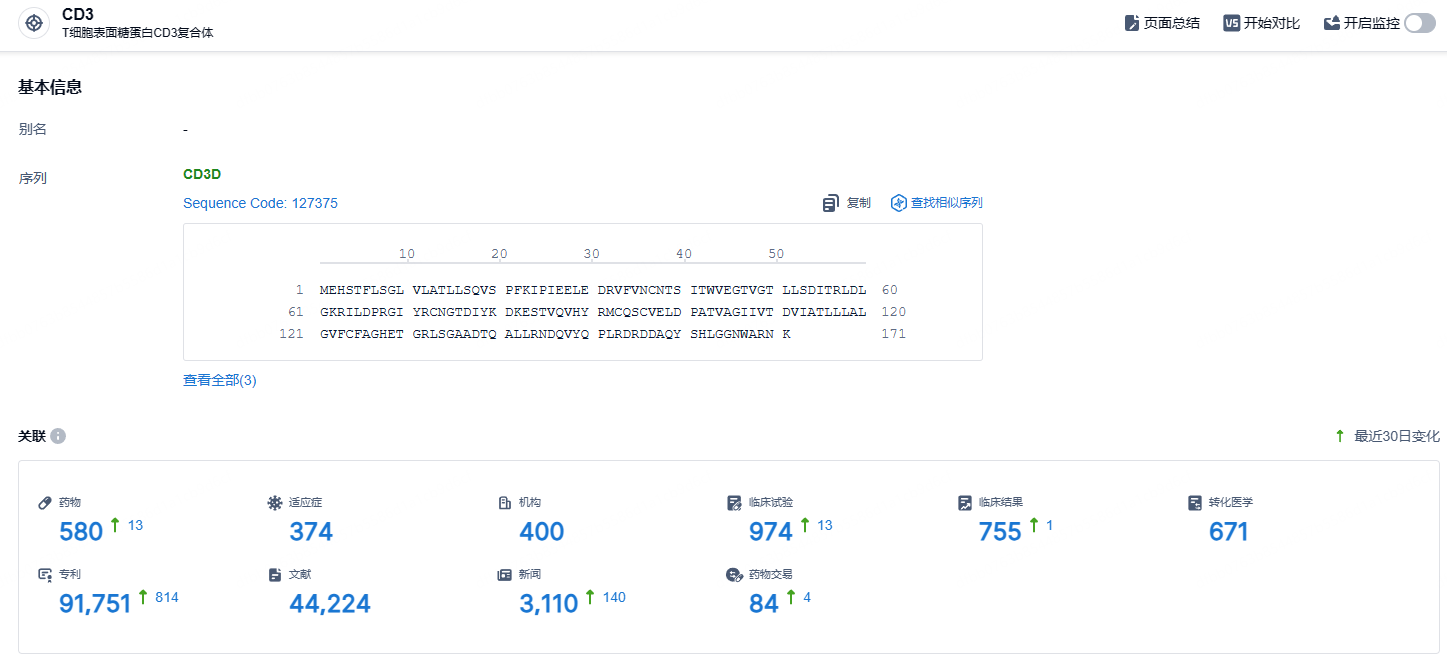
根据智慧芽新药情报库所披露的信息(点击下方图片直达CD3靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年8月21日,CD3靶点共有在研药物580个,包含的适应症有374种,在研机构400家,涉及相关的临床试验974件,专利多达91751件……1型糖尿病(T1DM)在一定程度上是可以预测的,而免疫治疗可以改变疾病的进程。FDA批准替利珠单抗/Teplizumab作为T1DM的首个疾病改善治疗和首个旨在延迟任何免疫介导病例临床发生的疗法,这标志着T1DM治疗模式的转变。期待替利珠单抗在国内早日获批,为国内患者带来新的治疗选择。