阿斯利康重磅PD-L1抑制剂度伐利尤单抗新适应症在美申报上市,针对小细胞肺癌
8月16日,阿斯利康(AstraZeneca)宣布,美国FDA已接受其重磅PD-L1抑制剂Imfinzi(durvalumab)的补充生物制品许可申请(sBLA)并授予其优先审评资格,用以治疗接受铂类同步放化疗(cCRT)后病情未进展的局限期小细胞肺癌(LS-SCLC)患者。FDA预计在2024年第四季度公布该申请的审评结果。此外,美国FDA在近期还授予Imfinzi突破性疗法认定(BTD)用以治疗此类患者群体。
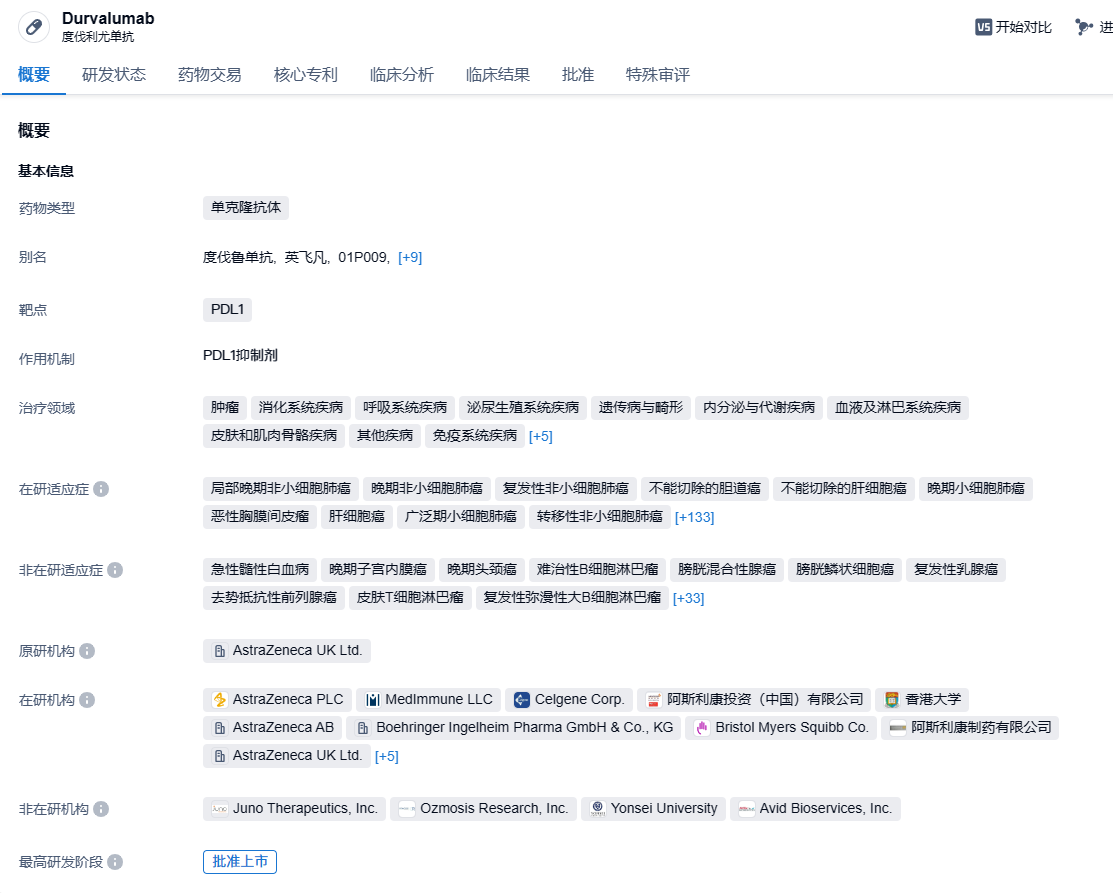
度伐利尤单抗是一种选择性、高亲和力的人源IgG1单克隆抗体,能阻断程序性死亡-配体1(PD-L1)与程序性死亡受体-1(PD-1)和CD80的结合,使T细胞识别和杀伤肿瘤细胞。PD-L1是一种表达于肿瘤细胞和肿瘤浸润细胞上的免疫检测点蛋白,通过与PD-1和B7.1结合下调抗肿瘤T细胞功能,因此,只要能阻断PD-1和B7.1的相互作用,就可以恢复抗肿瘤T细胞功能。2018年2月,美国FDA基于PACIFIC研究批准Durvalumab用于治疗无法手术、化疗或放疗后病情未进展的III期非小细胞肺癌患者,且肺癌NCCN指南已介绍度伐利尤单抗维持治疗含铂标准同步放化疗后疾病未进展的局部晚期不可切除的III期肺癌患者。目前,该药在我国也已获批用于治疗无法手术、化疗或放疗后病情未进展的III期非小细胞肺癌患者。
这次所递交的sBLA主要基于ADRIATIC临床3期试验的数据。分析显示,与安慰剂相比,Imfinzi将死亡风险降低了27%(HR=0.73;95% CI:0.57-0.93;p=0.0104)。Imfinzi组患者的的预估中位总生存期(OS)为55.9个月(95% CI:37.3-不可估计),而安慰剂组为33.4个月(95% CI:25.5-39.9)。预估有57%接受Imfinzi治疗的患者在三年内仍然存活,而此数值在安慰剂组患者中为48%。与安慰剂相比,Imfinzi还将疾病进展或死亡风险降低了24%(HR=0.76;95% CI:0.61-0.95;p=0.0161)。Imfinzi组患者的中位无进展生存期(PFS)为16.6个月(95% CI:10.2-28.2),而安慰剂组为9.2个月(95% CI:7.4-12.9)。据估计,接受Imfinzi治疗的患者中,有46%在两年内没有出现疾病进展,而接受安慰剂治疗的患者中,这一数值为34%。
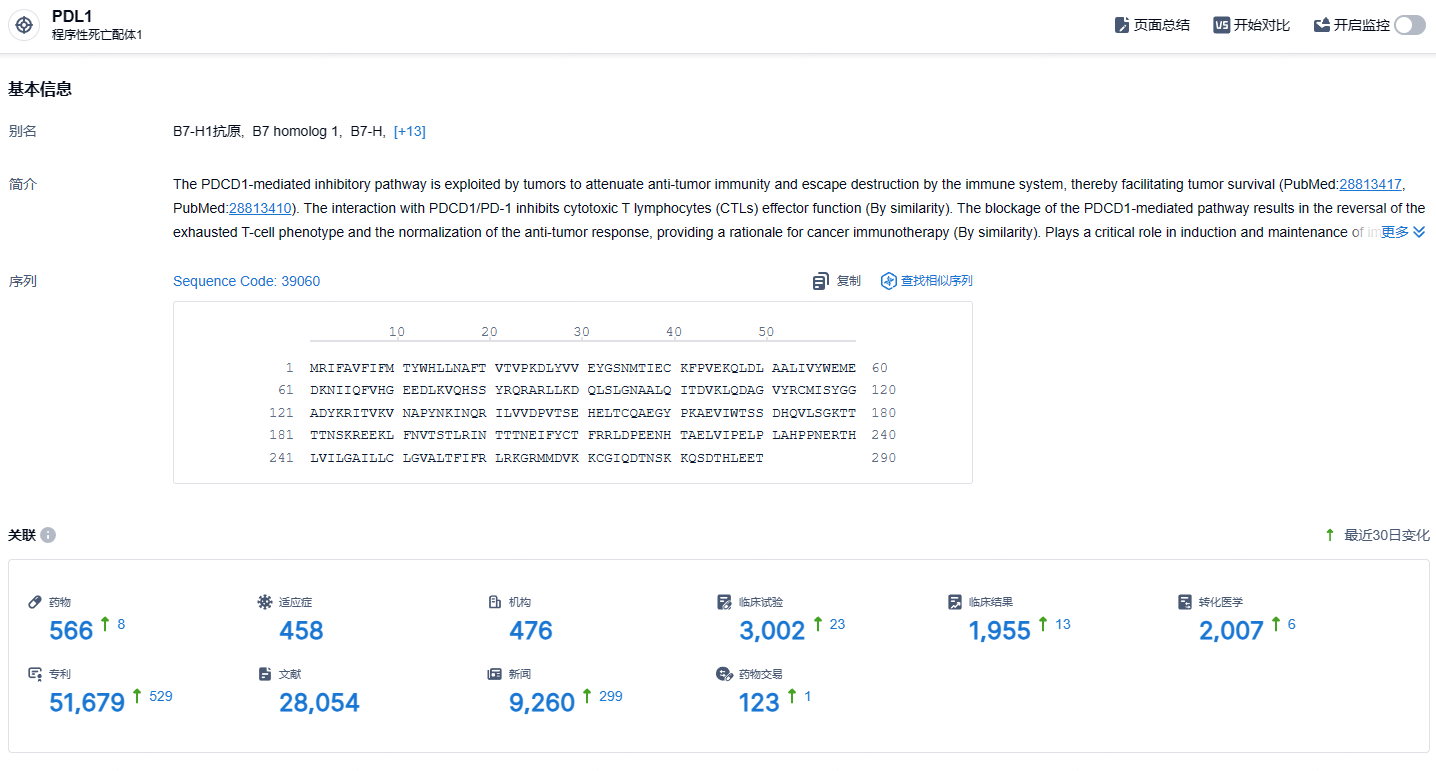
根据智慧芽新药情报库所披露的信息 (点击下方图片直达PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月18日,PD-L1靶点共有在研药物566个,包含的适应症有458种,在研机构476家,涉及相关的临床试验3002件,专利多达51879件……小细胞肺癌是一种高度侵袭性的肺癌形式,尽管LS-SCLC患者最初对化疗和放疗有应答,但通常会迅速复发和进展。对于LS-SCLC来说,患者的5年生存率只有15-30%。期待度伐利尤单抗这类免疫疗法能够给小细胞肺癌患者带来新的治疗选择。