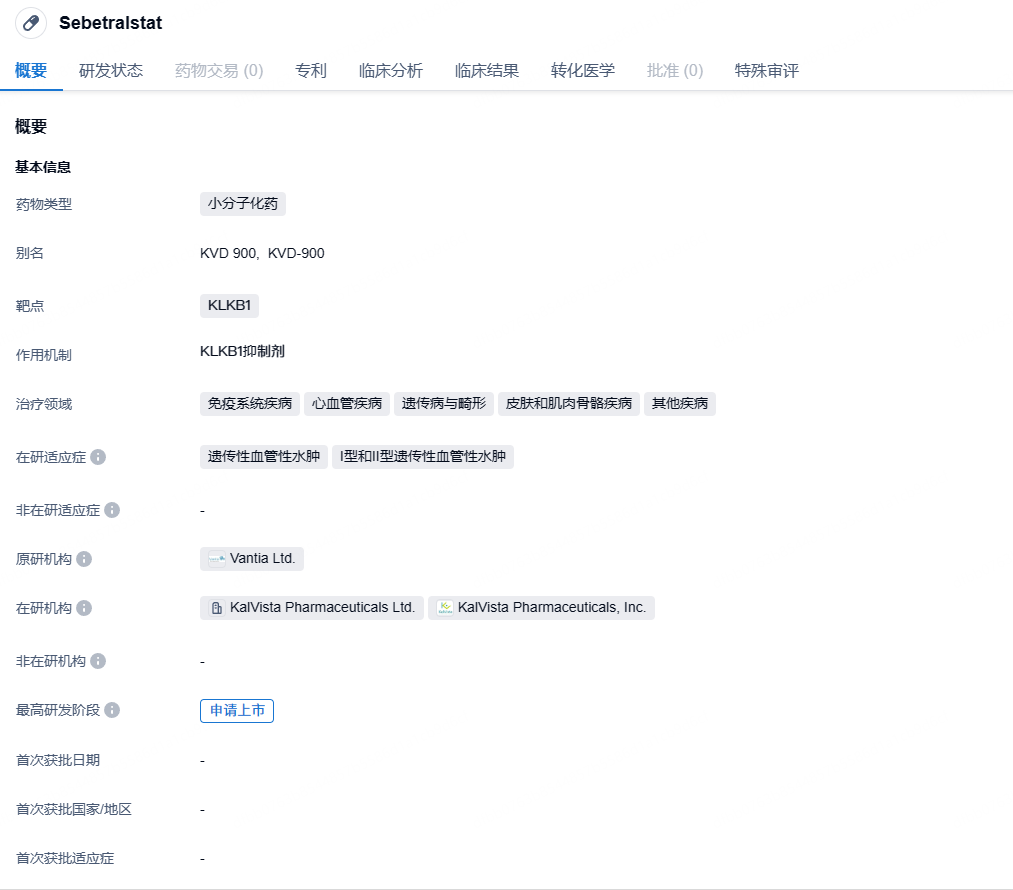
KalVista公司口服KLKB1抑制剂Sebetralstat上市申请获欧洲EMA接受,针对HAE
8月16日,KalVista Pharmaceuticals公司宣布,欧洲药品管理局(EMA)已接受其为sebetralstat递交的上市授权申请(MAA),用于按需治疗遗传性血管性水肿(HAE)。如果获得批准,它将成为欧盟首个按需治疗HAE的口服药物。
Sebetralstat是KalVista公司开发的口服血浆激肽释放酶(KLKB1)抑制剂,用于治疗遗传性血管性水肿(HAE)。HAE是一种罕见的常染色体显性遗传疾病,患者因体内缺乏C1酯酶抑制物(C1INH)或其功能存在缺陷而导致四肢、颜面、生殖器、呼吸道和胃肠道黏膜等身体多个部位毫无征兆地发生急性水肿。
MAA的提交得到了此前公布的临床试验结果支持,包括来自3期临床试验KONFIDENT和正在进行的KONFIDENT-S开放标签扩展试验的数据。2024年2月13日,KalVista制药公司宣布一项三期临床试验的积极结果,该试验显示sebetralstat作为口服治疗遗传性血管性水肿(HAE)具有统计学和临床显著的疗效。该临床试验满足了所有主要终点和关键次要终点,并显示出良好的安全性。300 mg和600 mg sebetralstat治疗HAE发作时达到症状开始缓解的主要终点明显快于安慰剂(300 mg组p<0.0001, 600 mg组p=0.0013)。到症状开始缓解的中位时间为:sebetralstat 300 mg组1.61小时(CI 1.28, 2.27), sebetralstat 600 mg组1.79小时(CI 1.33, 2.27),安慰剂组6.72小时(CI 2.33, >12)。主要终点和关键次要终点按固定的分层顺序进行分析,并根据多样性进行调整。主要次要终点显示:与安慰剂相比,sebetralstat 300 mg或600 mg治疗发作时,发作严重程度从基线降低的时间明显更快(300 mg p=0.0036, 600 mg p=0.0032)。与安慰剂相比,sebetralstat 300 mg或600 mg治疗的发作时间明显更快(300 mg p=0.0022, 600 mg p<0.0001)。
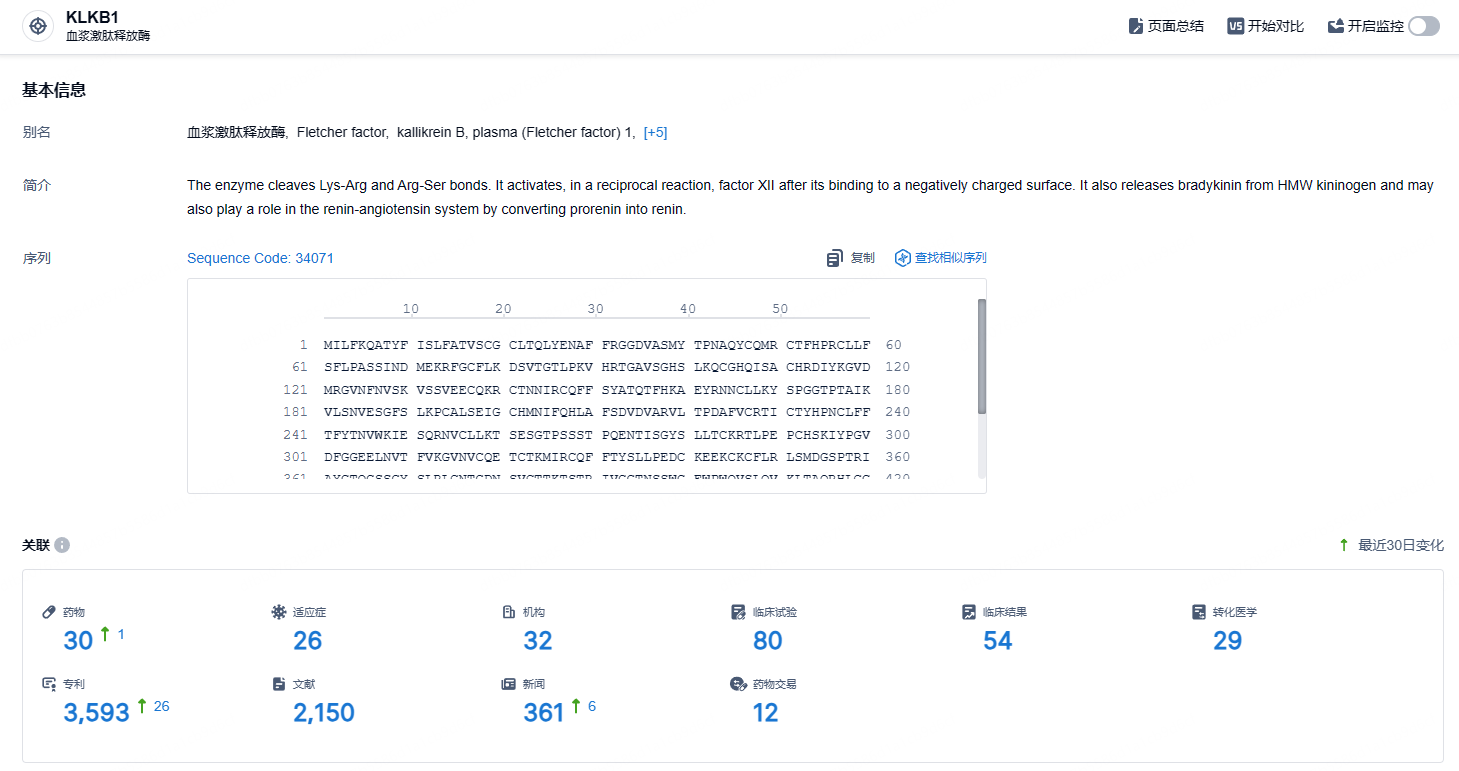
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达KLKB1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月18日,KLKB1靶点共有在研药物30个,包含的适应症有26种,在研机构32家,涉及相关的临床试验80件,专利多达3693件……口服sebetralstat耐受性良好,血浆激肽释放酶活性迅速受到抑制,从而显著延长使用常规治疗的时间,降低发作严重程度,并更快地达到症状缓解和消退的时间。期待该药尽早获批,为患者带来新的治疗选择。