赛诺菲宣布终止一款CEACAM5 ADC全球临床开发计划,信达生物拥有中国权益
2023年12月21日,赛诺菲宣布,终止tusamitamab ravtansine(SAR408701,IBI-126)的全球临床开发计划。该决定主要基于该产品二线治疗CEACAM5阳性转移性非鳞状非小细胞肺癌(nsqNSCLC)的III期CARMEN-LC03研究中期分析数据。
tusamitamab ravtansine是赛诺菲于2014年和Immunogen公司签订合作协议引进的一款靶向癌胚抗原相关细胞粘附分子5(CEACAM5)抗体-药物偶联物(ADC),是目前该靶点进度最快的药物。CEACAM5是由12种糖蛋白组成的CEACAM家族的成员,可以驱动细胞粘附和迁移,并抑制细胞凋亡,并且可能在许多不同的癌症类型中过表达。2022年8月,信达生物与赛诺菲达成肿瘤领域战略合作,其中就包括引进tusamitamab ravtansine在中国的临床开发和独家商业化权益。根据协议条款,赛诺菲有权获得累计最高达8000万欧元的潜在里程碑付款,以及该产品在中国获批上市后基于净销售额的特许权使用费。
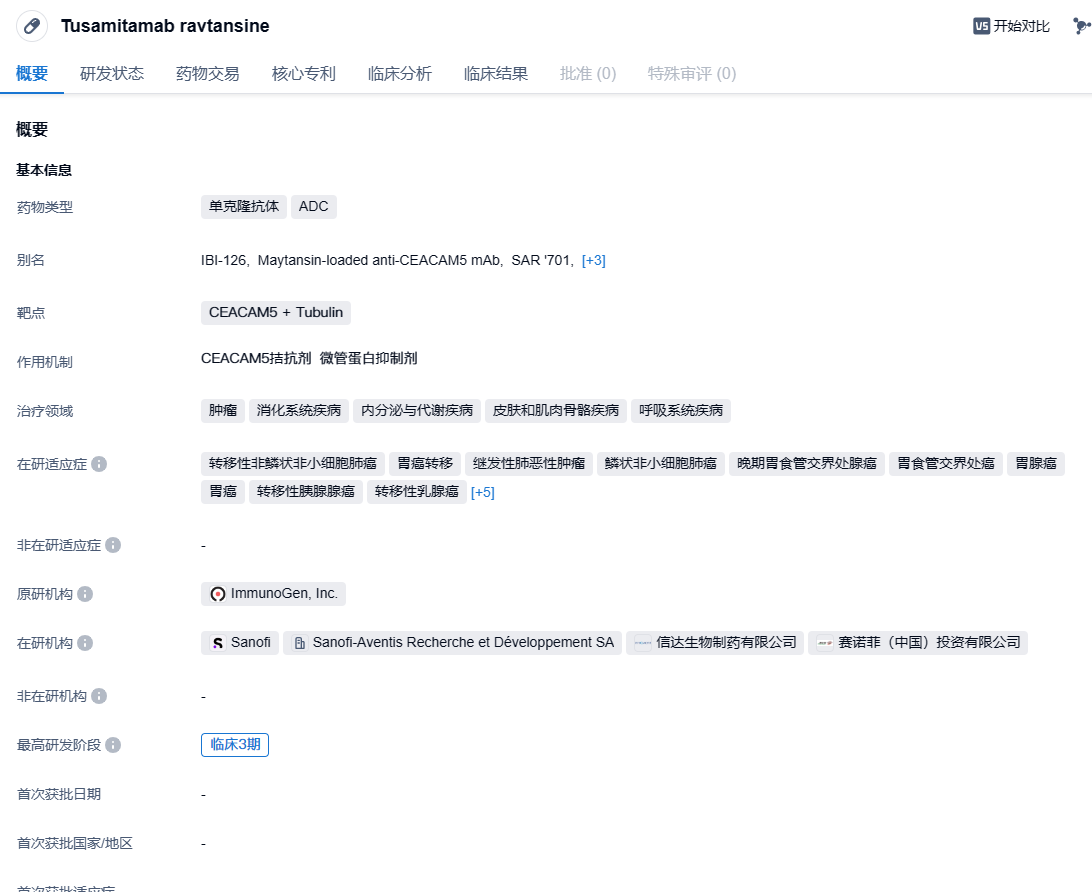
赛诺菲的该项决定基于3期CARMEN-LC03试验的预先指定的中期分析结果,该试验评估了tusamitamab ravtansine作为单药与多西他赛相比对先前治疗的肿瘤表达高水平CEACAM5转移性非鳞状(NSq)非小细胞肺癌癌症(NSCLC)患者的疗效。CARMEN-LC03试验的双重主要终点是无进展生存期(PFS)和总生存期(OS)。次要终点包括客观缓解率、健康相关的生活质量、安全性和缓解持续时间。独立数据监测委员会(IDMC)发现,与多西他赛相比,tusamitamab ravtansine作为单一疗法未达到PFS主要终点。尽管OS趋势有所改善,但最终分析显示,终止该项目是基于PFS没有改善。与多西他赛相比,tusamitamab raftansine具有与先前试验具有类似的安全性,各种重要临床类别不良事件的发生率较低。试验参与者如果他们从中受益将可以选择继续接受目前的治疗,或者过渡到适当的护理治疗标准。

根据智慧芽新药情报库所披露的信息 (点击下方图片直达CEACAM5靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月23日,CEACAM5靶点共有在研药物28个,包含的适应症有37种,在研机构41家,涉及相关的临床试验57件,专利多达4102件……目前,信达正在开展一项tusamitamab ravtansine联合信迪利单抗与tusamitamab ravtansine联合信迪利单抗+铂类化疗+培美曲塞治疗CEACAM5表达阳性nsqNSCLC患者的II期研究(CTR20231237)。此次tusamitamab ravtansine三期研发失败,给该药的后续研发蒙上了阴影。




