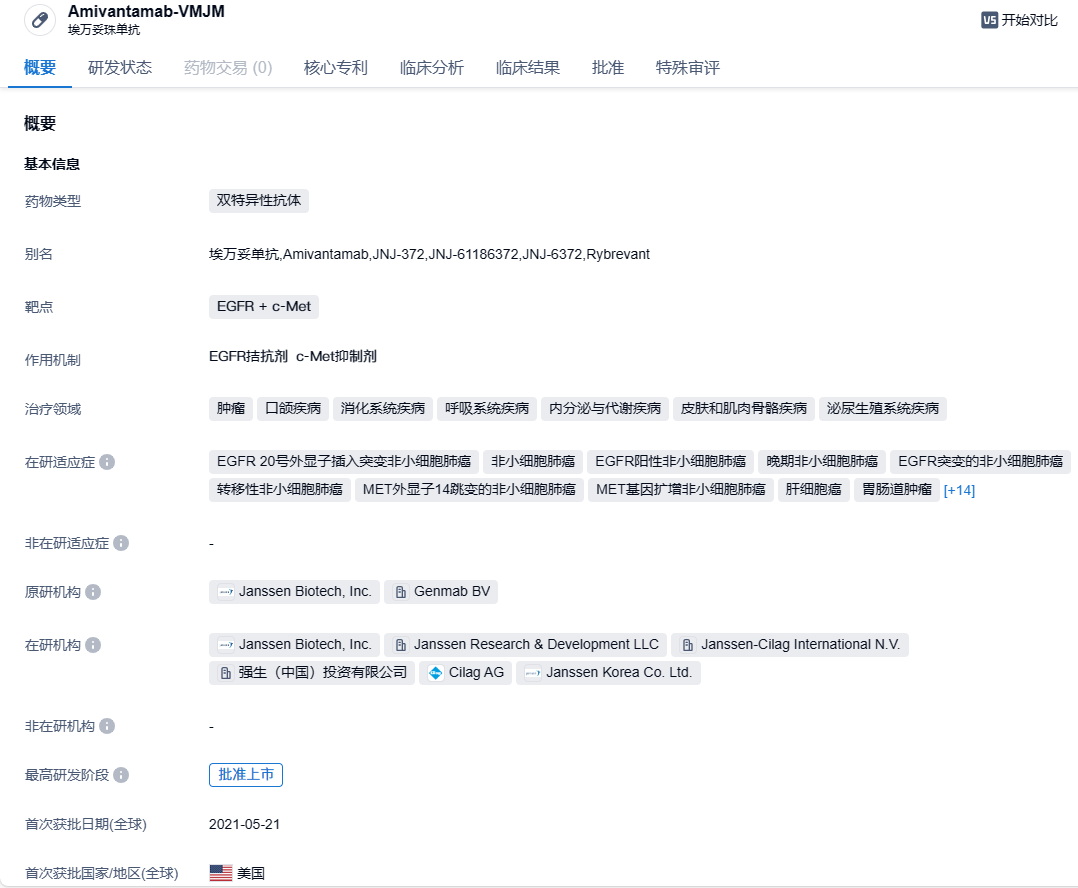
强生EGFR/c-Met双抗Amivantamab新适应症在欧美申报上市,一线治疗NSCLC
2023年12月23日,强生宣布,已向美国FDA和欧洲EMA递交EGFR/c-MET双抗Rybrevant(Amivantamab-vmjw)新适应症上市申请,寻求监管机构批准Amivantamab-vmjw联合第三代EGFR抑制剂Lazertinib一线治疗EGFR突变局部晚期或转移性非小细胞肺癌(NSCLC)患者。
Amivantamab是一款人源化EGFR + c-Met双特异性抗体。它具有多重抗癌作用机制,不但能够阻断EGFR和MET介导的信号传导,还可以引导免疫细胞靶向携带激活性和抗性EGFR/MET突变和扩增的肿瘤。2021年5月,Amivantamab获得美国FDA批准上市,用于治疗铂类化疗期间或之后进展的EGFR外显子20插入突变NSCLC患者。
该申请主要基于一项关键III期MARIPOSA研究数据,旨在评估Amivantamab-vmjw联合Lazertinib(A+L)对比三代EGFR TKI单药(奥希替尼)、Lazertinib一线治疗EGFR阳性晚期NSCLC的疗效及安全性。该试验共纳入1074名患者,按2:2:1随机分配为A+L组、奥希替尼组与Lazertinib组。结果显示,MARIPOSA研究达到了其主要终点,与奥希替尼治疗组相比,A+L治疗组患者的无进展生存期(PFS)具有统计学意义和临床意义的改善。此外,与奥希替尼治疗组相比,A+L治疗组显示出了OS的获益趋势。安全性方面,A+L联合用药的安全性与先前报道的数据一致。此前,强生已向FDA递交2项Amivantamab-vmjw补充生物制品许可申请(sBLA),适应症分别为联合化疗(卡铂-培美曲塞)用于EGFR突变局部晚期或转移性NSCLC患者的一线治疗、联合化疗治疗接受奥希替尼治疗期间或之后疾病进展的EGFR突变NSCLC患者。
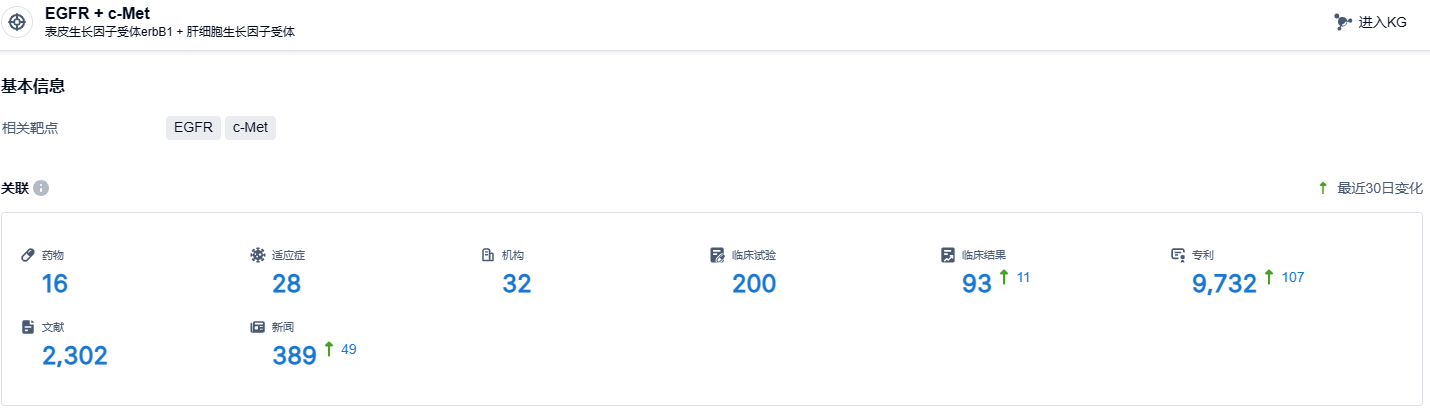
根据智慧芽新药情报库所披露的信息 (点击下方图片直达EGFR + c-Met靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月23日,EGFR + c-Met靶点共有在研药物17个,包含的适应症有36种,在研机构32家,涉及相关的临床试验200件,专利多达9613件……基于Amivantamab优异的数据,预计EGFR/c-Met双抗药物有望成为EGFR领域下一代重磅产品。国内企业中,岸迈生物、贝达药业、嘉和生物、和翰森制药等企业布局了EGFR/c-Met赛道,期待这些国产新药的后续表现。