JAK3药物靶点研发进展
Janus激酶是通过传递来自50多种细胞因子的信号在免疫反应中发挥重要作用的蛋白家族,因此成为治疗自身免疫性疾病的潜力靶点。然而,目前可用的JAK抑制剂在抑制细胞因子信号时缺乏选择性,导致一些不良反应。因此,下一代抑制剂需要在保持疗效的同时避免不良事件的发生。在JAK家族中,JAK3是仅调控γc细胞因子的窄谱成员,因此成为一个潜在的理想靶点。Janus激酶家族有四个亚型:JAK1、JAK2、JAK3和TYK2(酪氨酸激酶2),它们通过JAK/STAT途径传递信号。JAK1、JAK2和TYK2广泛表达,而JAK3主要在淋巴组织中表达,并且是淋巴细胞发育的选择性调节因子,在免疫系统中发挥重要功能。JAK3与一种细胞因子受体亚基(共同γ-亚基或γc链)有选择性结合。
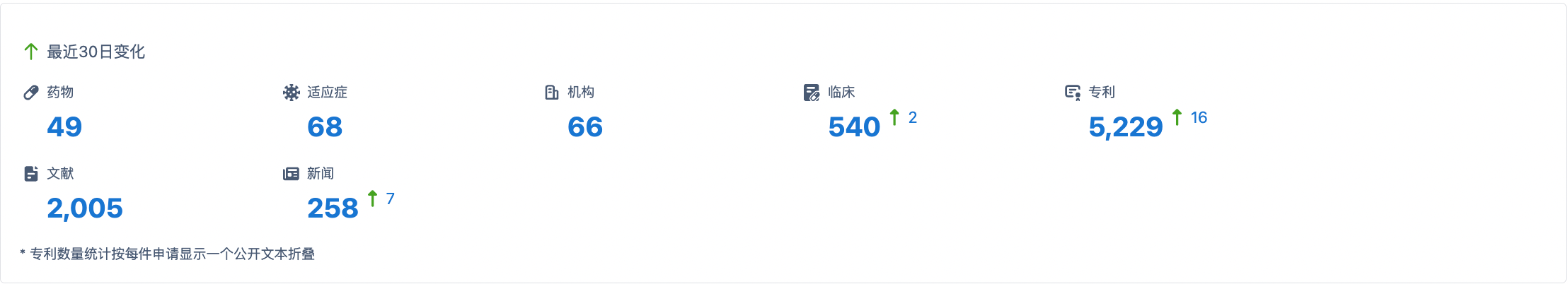
截至目前,已有49种以JAK3为靶点的药物被发现,并涵盖了68个不同的适应症。相关研发机构达到66家,临床试验相关的数据显示,已有540项临床试验结果与JAK3靶点药物相关。同时,JAK3靶点药物的研发也受到了广泛的关注和保护,目前已有5229项专利申请与JAK3靶点药物相关。为了支撑JAK3靶点药物研究的进展,已有2005篇文献发表,为进一步的研究提供了重要的参考。
竞争格局
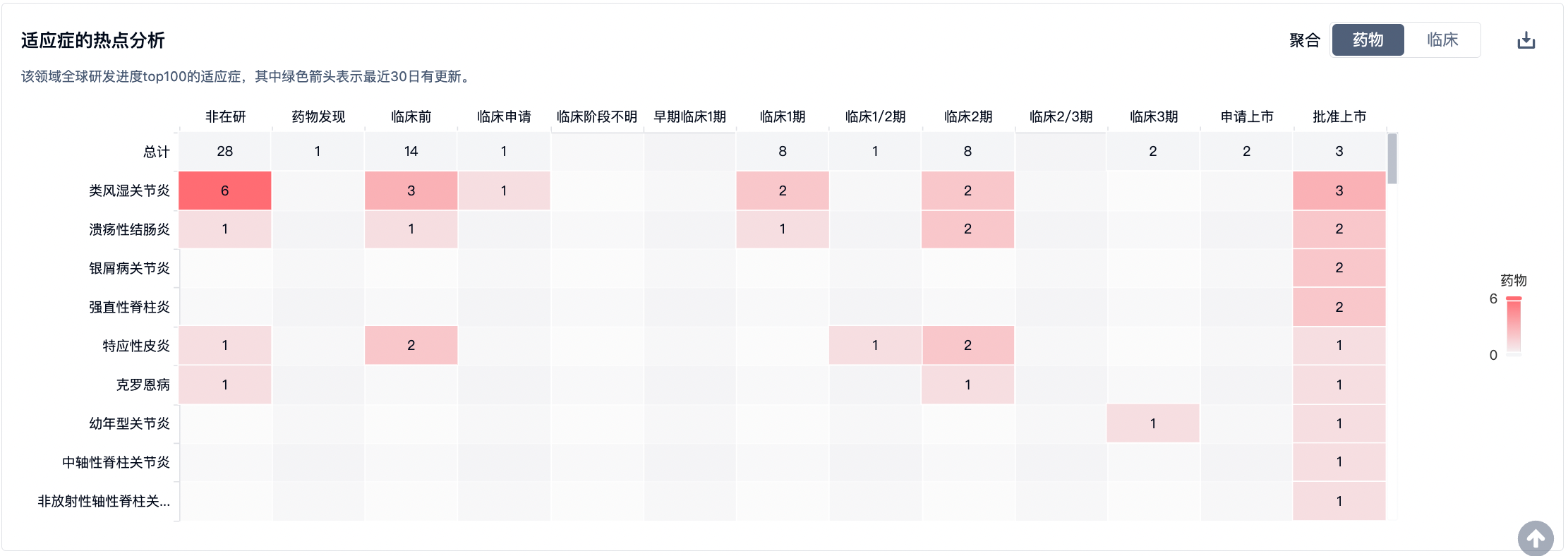
根据智慧芽新药情报库的数据显示,针对JAK3靶点的药物正在广泛研发,涵盖了多个适应症领域,重点指向自免疾病。对于类风湿关节炎,已有11种药物在开发中,针对溃疡性结肠炎和特应性皮炎,分别有6种药物正在研发。
重点药物
Ritlecitinib是一种针对JAK3的不可逆抑制剂,根据截至2023年3月的智慧芽数据库搜索结果显示,针对类风湿性关节炎的单药和联合用药的二期临床试验均以失败告终。而针对溃疡性结肠炎的三期临床试验和克罗恩氏病的二期临床试验仍在进行中。辉瑞公司计划在2023年对I型糖尿病进行II期临床试验(NCT05743244),这使得Ritlecitinib成为目前临床进展最快的JAK3选择性抑制剂之一。
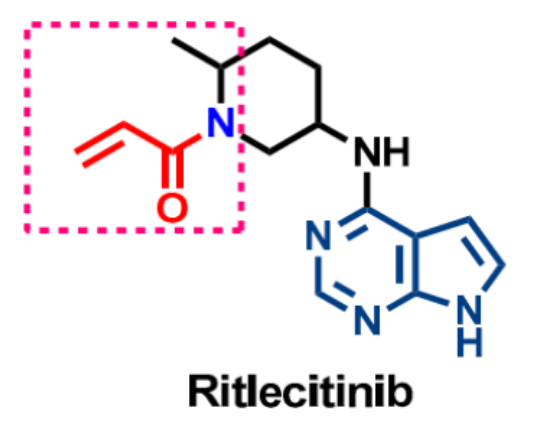
Ritlecitinib通过与JAK3中的Cys909残基发生共价结合来发挥其抑制活性,提高了对JAK3的选择性。其对JAK3的IC50为33.1 nM,而对JAK1、JAK2和TYK2几乎没有抑制活性(IC50>10,000 nM)。此外,Ritlecitinib还通过抑制Th1和Th17的功能来发挥作用,通过抑制IFNγ(IC50=48 nM)和IL-17(IC50=269 nM)的产生来实现。
JAK抑制剂治疗炎症性肠病(IBD)的机制是通过阻断免疫细胞之间的通讯。2018年5月,FDA批准了口服小分子抑制剂Tofacitinib用于治疗中重度溃疡性结肠炎。Tofacitinib可抑制JAK1和JAK3,从而阻断下游的JAK/STAT信号通路,调节DNA转录。选择性JAK1抑制剂Itacitinib在急性移植物抗宿主病(aGVHD)患者中显示出良好的疗效,但由于副作用的原因,已中止了其在胰腺癌、斑块性银屑病和类风湿性关节炎等适应症的研究。选择性JAK3抑制剂是否能够降低广泛抑制细胞因子带来的副作用,至少从Ritlecitinib的一期临床数据来看,得到了验证。此外,在研究中并未观察到重大不良心脏事件(MACE)、死亡或机会性感染的发生。
在去年9月,美国和日本监管机构分别批准了TYK2抑制剂deucravacitinib用于治疗中重度斑块型银屑病。deucravacitinib也成为了TYK2信号通路中第一个上市的选择性抑制剂。这一成功上市的案例再次证明了JAK/STAT通路的药物研发潜力。经过30年的研究,人们对这一通路的了解越来越深入,针对JAK激酶亚型的功能研究也逐渐加深,上市的药物从早期的泛抑制剂发展到对两个亚型或某一个亚型具有高度选择性的抑制剂。JAK3高度选择性抑制剂能否像TYK2抑制剂一样成功上市,这还需要时间来验证。