Efgartigimod——重症肌无力药物全新突破
Efgartigimod/Hyaluronidase皮下注射剂,商品名VYVGART HYTRULO,是一种靶向FcRn的含有efgartigimod alfa和hyaluronidase(重组人透明质酸酶PH20)两种成分的复方制剂。该药物是由Argenx BV在其公司旗下产品VYVGART(efgartigimod alfa-fcab,静脉输注,2021年12月获批上市)的基础上改良并添加了可增强皮下组织通透性的hyaluronidase,进而改为皮下注射制剂。2023年6月20日获得美国食品药品监督管理局(以下简称:FDA)的批准,用于治疗乙酰胆碱受体(AChR)抗体阳性的全身性重症肌无力症(gMG)成人患者。
研发状态
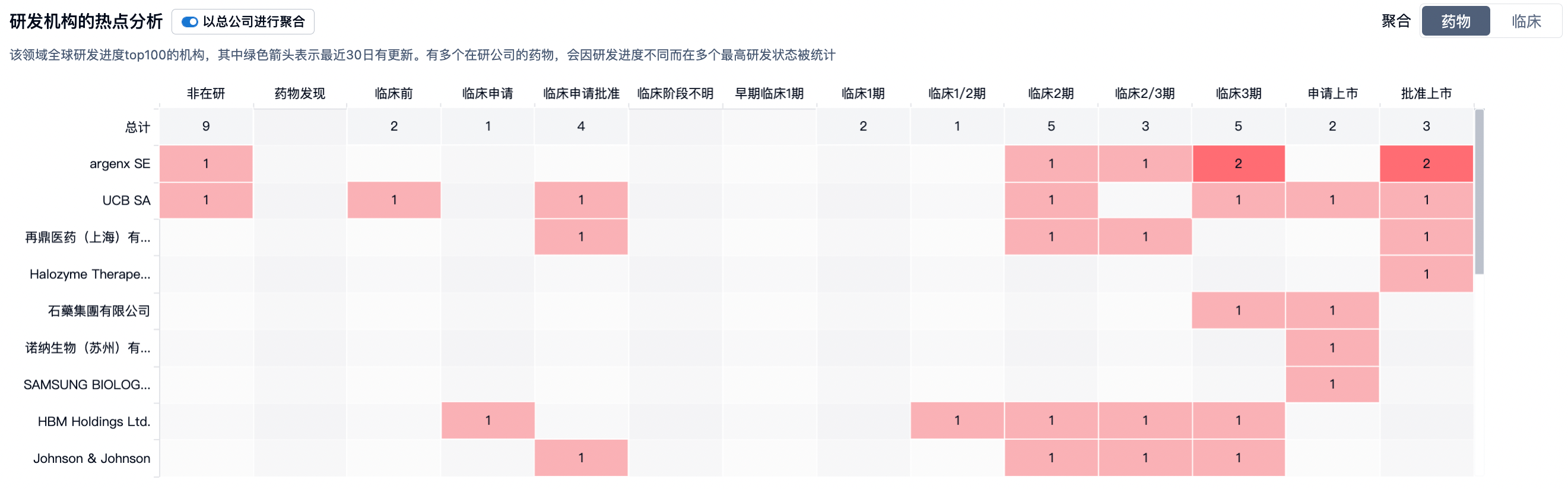
除已获批的重症肌无力外,当前该药物的研究重点为评估用于严重自身免疫性疾病患者的疗效,原发性免疫性血小板减少症(ITP)、寻常型天疱疮和落叶型天疱疮(Pemphigus Vulgaris and Foliaceus, PV & PF)、CIDP的研究已较为成熟,未来有望获批。
Efgartigimod是FDA批准的治疗这类患者群体的首款皮下注射疗法。这一剂型改良可将静脉输注所需的1个小时缩短为皮下注射的30-90秒。FDA发送给Argenx BV的letter中显示,由于efgartigimod/hyaluronidase的临床试验中有关妊娠、哺乳期人群的研究不足,上市后需补充相关研究,要求“开展一项全球性研究,收集妊娠和/或哺乳期间接触VYVGART Hytrulo的妇女的前瞻性和回顾性数据,以评估妊娠和哺乳期妇女出现并发症的风险、对发育中的胎儿和新生儿的不良影响”及开展另一项研究以“评估母乳中efgartigiod alfa的浓度以及对母乳喂养婴儿的影响(如适用)”。
作用机制
Efgartigimod是首款靶向FcRn的疗法。Efgartigimod可减少致病性IgG抗体,阻断IgG再循环过程。FcRn可防止IgG的降解,因此通过防止IgG与FcRn的结合,能够导致介导自身免疫性疾病的IgG抗体更快耗竭,从而减轻疾病症状。另一种成分hyaluronidase,可通过降解透明质酸来增加皮下组织的通透性,以促进药物的吸收,这种作用是短暂的,皮下组织的渗透性在24-48小时内可自行恢复。
临床疗效
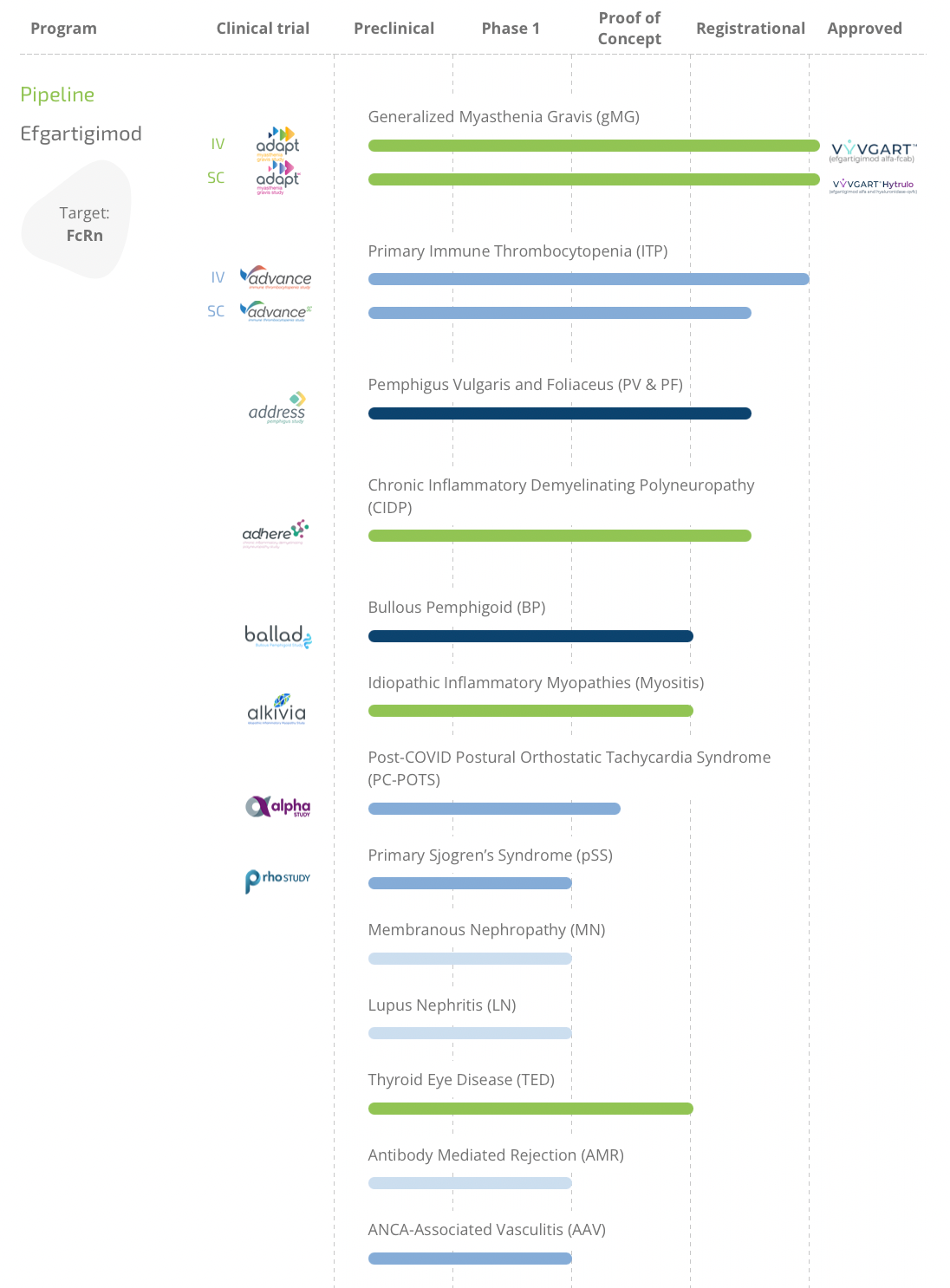
首先在药理作用方面,将efgartigimod/hyaluronidase与efgartigimod进行对比,皮下注射1,008 mg / 11,200 Units的efgartigimod/hyaluronidase、静脉输注10 mg/kg的efgartigimod,在第4周时,两组AChR-Ab水平的平均降低率为62.2%和59.7%,总IgG水平的下降趋势类似。两种制剂之间没有显著差异。在早期对efgartigimod的安慰剂对照研究(NCT03669588)中显示,在第一个治疗周期中,MG-ADL应答率为:治疗组67.7%,安慰剂组29.7% (p<0.0001),具有显著差异(图2-6)。这为皮下注射剂的开发奠定了疗效依据。
安全性
Efgartigimod最常见(发生率>10%)的不良反应是呼吸道感染,头痛和尿路感染;efgartigimod/hyaluronidase主要是注射部位反应和头痛。
竞争格局
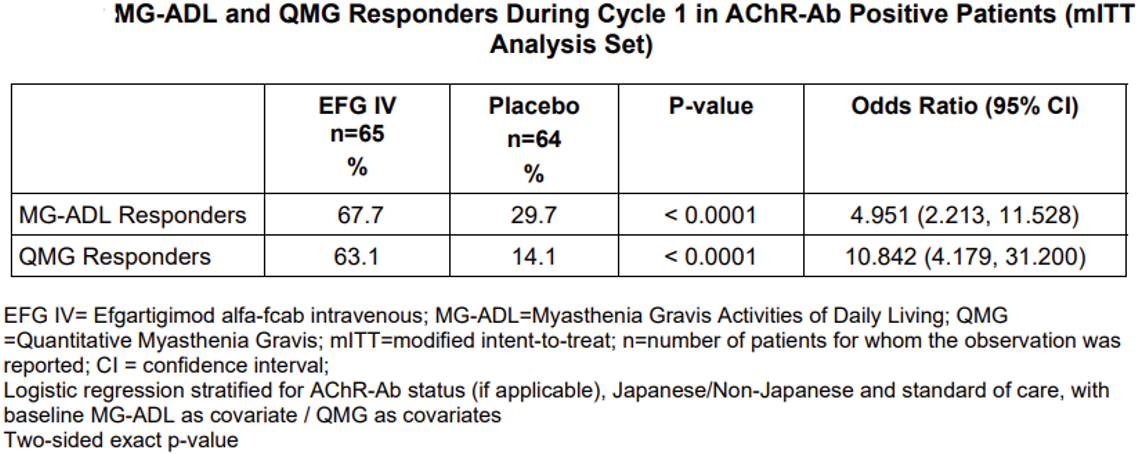
据智慧芽新药情报库数据统计,FcRn靶向药物共12个,其中3款已经上市,另一款药物Batoclimab(巴托利单抗)进入上市申请阶段。处于研发后期的药物均布局了重症肌无力,总体来看,赛道的竞争性较弱。更多详细数据,请点击下方图片链接获取。