诺和诺德长效疗法「注射用培图罗凝血素α」在国内申报上市
2023年7月25日,中国国家药监局药品审评中心(CDE)官网最新公示,诺和诺德(Novo Nordisk)递交了注射用培图罗凝血素α的新药上市申请,并获得受理。公开资料显示,这是长效重组凝血因子VIII(FVIII)turoctocog alfa pegol(N8-GP),已在美国获批用于成人和儿童血友病A患者的预防性治疗和急性治疗。
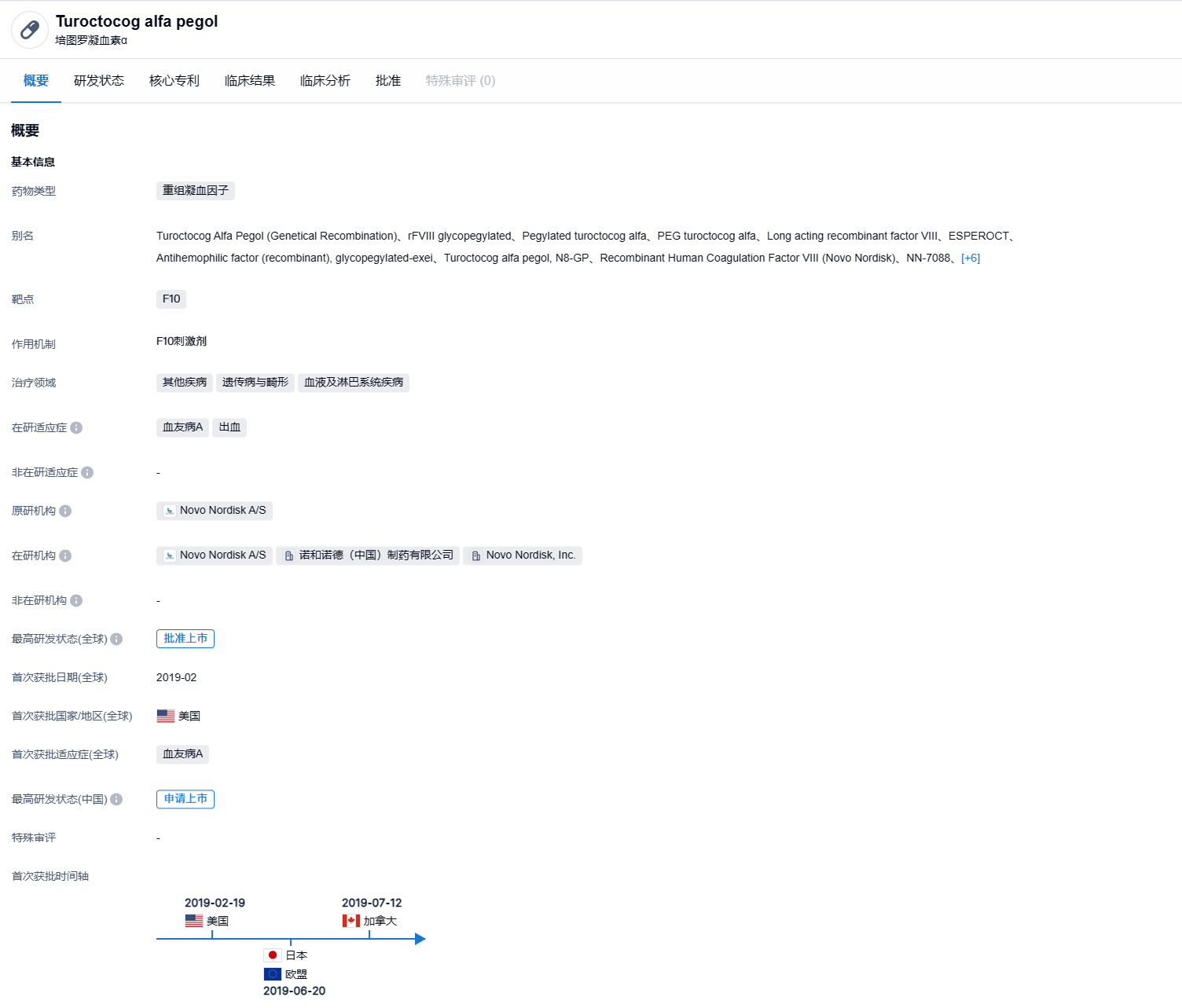
注射用培图罗凝血素α(Turoctocog alfa pegol)是诺和诺德基于Turoctocog alfa 开发的一款长效重组凝血因子 Ⅷ(FⅧ)。根据智慧芽新药情报库显示,该产品最早于 2019 年 2 月获 FDA 批准上市,用于成人和儿童血友病A患者的预防性治疗和急性治疗,同年也在欧盟、日本获批。培图罗凝血素α经聚乙二醇(PEG)修饰后半衰期得到显著延长,与非修饰FVIII产品相比,N8-GP在成人/青少年中半衰期延长了1.6倍,在儿童中半衰期延长了1.9倍。
Turoctocog alfa pegol在FDA的批准,基于在A型血友病中开展的规模最大、时间最长的临床项目PATHFINDER的数据,共有5项跨国研究,涉及270例患者。该项目评估了Turoctocog alfa pegol用于成人患者、儿童患者按需治疗、预防性治疗、外科手术止血的疗效和安全性。结果显示,Esperoct通过一种简单的、固定剂量给药方案(成人和青少年每4天一次、儿童每3-4天[每周2次]一次),在重度A型血友病(内源性FVIII活性<1%)患者中可提供有效的常规预防。在成人及青少年(≥12岁)患者中,Turoctocog alfa pegol每4天给予50 IU/kg剂量时,能够提供有效的预防作用,并维持低至1.18次事件的年平均出血率(ABR)。在12岁以下儿童患者中,Turoctocog alfa pegol每周2次给予60 IU/kg(50-75 IU/kg)剂量时,中位ABR为1.95次。此外,研究结果还显示,Turoctocog alfa pegol在治疗和控制出血事件和围手术期管理方面同样有效。横跨所有研究和年龄组,Turoctocog alfa pegol的耐受性良好,未发现安全问题。Turoctocog alfa pegol的总体安全性与报告的其他长效FVIII产品相似。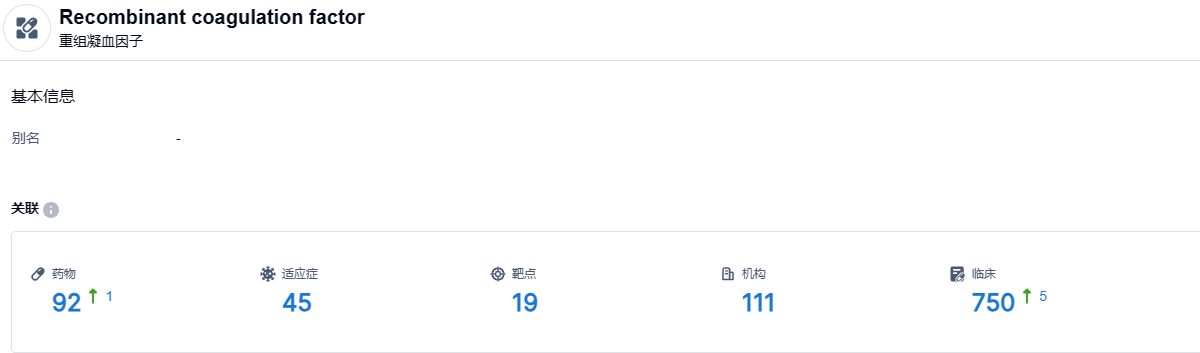
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 重组凝血因子 药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2023 年7月26日,重组凝血因子这一药物类型共有在研药物92个,包含的适应症有45种,靶点19个,在研机构111家,涉及相关的临床试验750件……期待培图罗凝血素α能够顺利在国内上市,为国内患者带来新的治疗选择。