诺华ETA拮抗剂阿曲生坦拟纳入优先审评,针对IgA肾病
11月12日,诺华ETA拮抗剂阿曲生坦(atrasentan)拟纳入优先审评,用于降低有疾病进展风险的原发性免疫球蛋白A肾病(IgAN)成人患者的蛋白尿。
Atrasentan是一种高效的内皮素受体拮抗剂,通过强效选择性地阻断ETA受体,减少蛋白尿,并具有抗炎和抗纤维化的特性,从而有助于保护肾脏功能。Atrasentan的开发最初由AbbVie公司进行,主要针对糖尿病肾病(DKD)。在进行的多项临床试验中,包括一项名为SONAR的第三阶段临床试验,该药物在超过5000名DKD患者中显示出了显著的效果,包括在其主要终点上达到统计学显著性(p值为0.029)。Chinook Therapeutics公司后来从AbbVie公司获得了Atrasentan的许可,并将其作为治疗IgAN的主要适应症进行评估。2023年,诺华以35亿美元收购了Chinook公司,获得了atrasentan和APRIL单抗zigakibart两款IgA肾病药物。
2024年5月25日,诺华公布一项预先指定atrasentan的III期ALIGN研究的中期分析结果,atrasentan治疗的患者,除支持治疗(最大耐受和稳定剂量的肾素-血管紧张素系统[RAS]抑制剂)外,在36周时,与安慰剂相比,蛋白尿(通过24小时尿蛋白与肌酐比值[UPCR]测量)减少了36.1% (p<0.0001)。
在第61届欧洲肾脏协会大会(ERA 24)上,该试验分析结果(包括340名患者试验中的前270名患者)表明,使用atrasentan可显著降低蛋白尿。如果批准,内皮素A (ETA)受体激动剂可以为IgA肾病患者提供额外的选择。该研究还表明,atrasentan具有良好的安全性,与先前报道的数据一致。
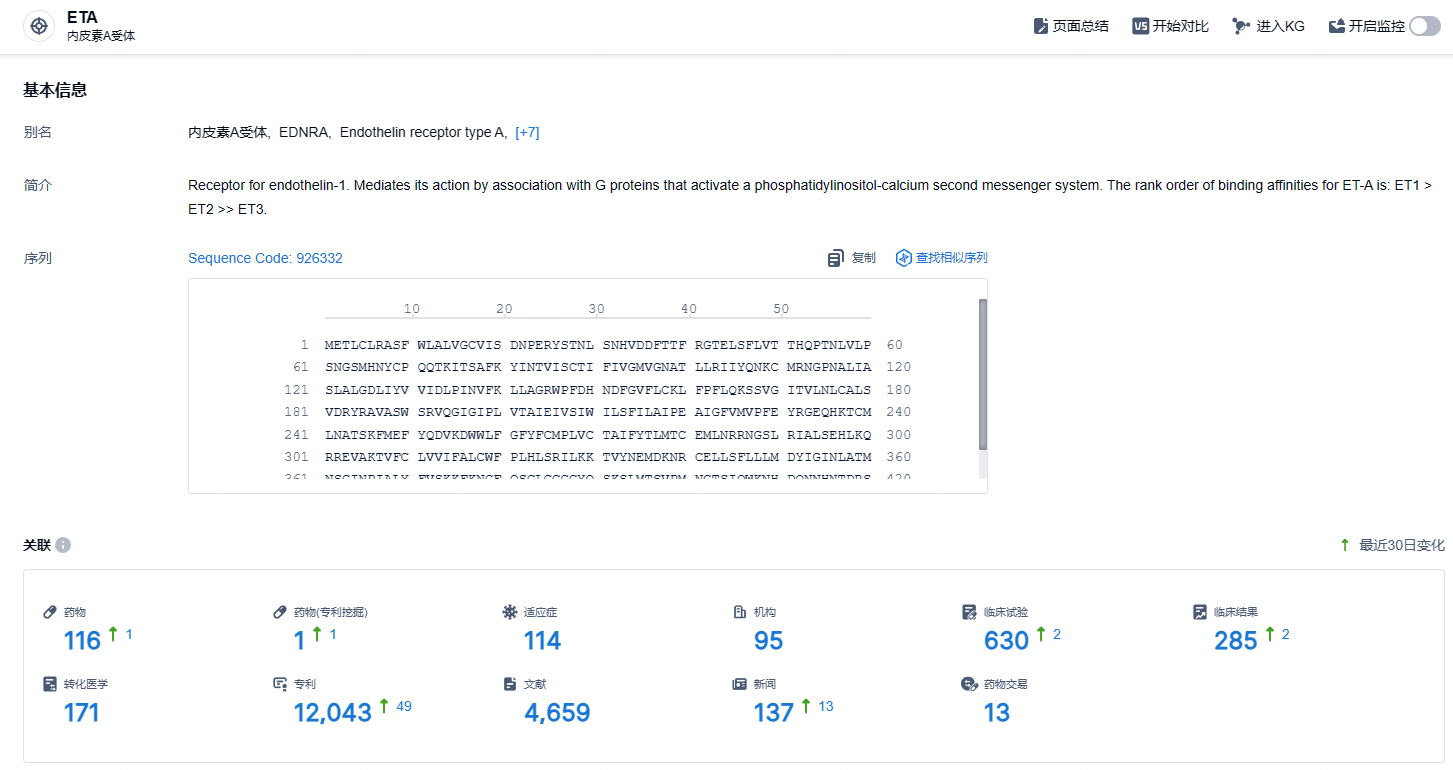
根据智慧芽新药情报库所披露的信息 (点击下方图片直达ETA靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月13日,ETA靶点共有在研药物116个,包含的适应症有114种,在研机构95家,涉及相关的临床试验630件,专利多达12043件……IgA肾病是我国人数最多的一种肾小球疾病(占40%-50%),是我国现存尿毒症的最大来源。自1968年被人类发现以来,保持着每隔10年有20%的患者进展为尿毒症的速度。期待这款ETA拮抗剂能够早日获批,为患者带来新的治疗选择。